寄主内存的作用
内存的作用 时间:2021-01-16 阅读:()
收稿日期:2002207228;修回日期:2003206202基金项目:国家自然科学基金(30270865);教育部科学技术研究重点项目(01098)3通讯作者E-mail:xbzheng@mail.
njau.
edu.
cn作者简介:张正光(1972-),男,湖南新邵县人,讲师,博士,主要从事真菌遗传与分子生物学及病原菌与植物互作研究.
植物病理学报ACTAPHYTOPATHOLOGICASINICA33(5):3852390(2003)植物对卵菌的非寄主抗病性张正光,王源超,郑小波3(南京农业大学植保学院,农业部病虫监测与治理重点开放实验室,南京210095)Nonhost2resistanceofplanttooomycetesZHANGZheng2guang,WANGYuan2chao,ZHENGXiao2bo3(TheKeyLabofMonitoringandManagementofPlantDiseasesandInsects,ChinaMinistryofAgriculture,CollegeofPlantProtection,NanjingAgriculturalUniversity,Nanjing210095,China)中图分类号:Q9491323;S43212文献标识码:A文章编号:041220914(2003)0520385206卵菌是多分枝的群体,包括60多种疫霉菌、多个活体营养的霜霉菌和100多种腐霉菌,其中许多是植物病原菌.
卵菌在系统进化上有别于其它植物病原真菌,形成一个独立的群体[1],所致病害给许多农作物和花卉植物造成毁灭性危害[2].
引起爱尔兰饥荒的Phytophthorainfestans现每年给全球造成数十亿美元的损失[3];最近在美国太平洋沿海Phytophthoraramorum侵染橡胶树而造成成片树木突然死亡[4].
100多年来,为了控制该群病原生物所致病害,世界各国的真菌学和植物病理学工作者从不同角度对疫霉菌进行了大量地研究,但由于从寄主植物中难以获得抗性持久的抗源,而且缺乏针对卵菌的有效杀菌剂,因此长期以来人们很难控制卵菌引起的植物病害.
卵菌的寄主范围很广,但不同种卵菌的寄主范围差异很大.
有些卵菌侵染不同种植物时呈现出高度的寄主专化性,如P.
infestans只侵染马铃薯和番茄等少数几种植物而不能侵染其它植物[1].
但是该群生物中不少种的致病力分化不明显,很难从寄主材料中找到抗源,此外专化性抗性基因容易因病原菌的变异而丧失抗性,致使这种病害难以控制,因此对疫霉菌等卵菌的非寄主抗性分子机制倍受人们关注[1,5~7].
非寄主抗病性具有稳定持久的特点,可望用来设计植物的抗卵菌基因工程.
本文综述了卵菌的寄主专化性、基本致病性和植物对卵菌抗性的最新进展及植物与卵菌特别是疫霉菌的非寄主抗性和过敏反应(hypersensitiveresponse,HR)之间的关系.
1卵菌的系统进化关于卵菌的系统进化来源,很长时间内存在着不同的观点.
由于卵菌呈丝状生长,因此人们通常错误地将其视为真菌.
根据生化分析和核糖体RNA序列及线粒体基因序列建立的系统发育树分析表明卵菌与真正的真菌(truefungi)亲源关系较远,是完全不同于丝状真菌的真核植物病原生物,而与原生生物界的金褐藻和不等鞭毛藻(heterokontalgae)亲缘关系更近,是一个具有种的多样性群体,包括侵染动植物的病原菌和一些腐生菌(如水霉)[8].
最近根据线粒体基因编码蛋白和4个保守细胞核基因编码蛋白的氨基酸序列[9]建立的系统发育树亦支持上述结论.
可见,卵菌进化成能侵染植物而与其它植物病原真菌不同的群体可能有自己特殊的机制.
对于卵菌属内不同群体的进化关系,Cooke等[10]利用核糖体DNA转录间隔区ITS(internaltranscribedspacer)对50个疫霉种及相关卵菌的亲源关系进行了研究,发现尽管Phytophthora具有高度的多样性,但仍为一个单系演化群体(monophyleticgroup),即起源于共同的祖先;认为活体营养的专性寄生霜霉菌可能起源于疫霉菌,是Phytophthora和Peronospora长期进化过程中的派生现象,且可能是进化的趋势.
然而疫霉菌对寄主具有较强的适生性,如尽管侵染番茄和马铃薯的P.
infestans与侵染Mirabilisjalapa的Phytoph2thoramirabilis和侵染利马豆的Phytophthoraphaseoli形1995-2004TsinghuaTongfangOpticalDiscCo.
,Ltd.
Allrightsreserved.
图卵菌主要属的进化[5]Fig.
Phylogeneticevolutionaryrelationshipsamongthemajorgeneraofoomycetes[5]成一个单系演化群体[10,11],但是最近有研究报道P.
infestans可侵染多种茄科植物,如野生的茄属植物、矮牵牛和Nicotianabenthamiana[12].
人们通过对卵菌群体内系统发育关系研究后,对卵菌的寄主专化性和致病性的进化有了深入的了解[13,14].
认为卵菌侵染植物的能力在进化过程中最少发生了两次飞跃(图),对植物具有致病性可能最早出现在古老的腐霉科生物,其中包括疫霉属中大多数种,后来Aphanomyces属的一些物种也进化成植物病原菌,这些物种与腐霉科亲源关系较远,而与动物病原菌关系非常密切.
因此腐霉科的物种在卵菌进化早期获得了侵染植物的能力,随后发展成现在的群体;而Aphanomyces属可能在较晚期独立地进化成寄生植物的群体[5].
可见对腐霉科的生物、Aphanomyces及动植物病原菌的基因组比较分析可能有利于鉴定植物病原卵菌与致病性相关的基因.
2植物对卵菌的非寄主抗病性某种植物的所有个体对某种病原菌表现的抗病性称为非寄主抗病性,是植物最主要的抗病类型,这种抗病性不是由植物单个专化性抗病基因控制的,不易随着病原菌的变异而丧失,具有抗性稳定持久的特点[15].
非寄主抗性的机制包括预存性结构屏障、预存毒性化合物以及由于病原菌侵染的诱导使植物产生的诱导型主动抗病反应.
虽然植物预存的结构屏障和毒性化合物如皂苷(主要作用于细胞膜中甾醇)是多数植物病原真菌的主要抗性机制,但是还没有证据表明结构屏障对卵菌具有抗病作用[4].
因为卵菌细胞壁中不含植物皂苷的作用靶子———甾醇,因此植物对该类病原菌的非寄主抗性与其它丝状真菌可能不同,而是由不同的遗传和生化机制调控,其中诱导型主动抗病性可能是植物对卵菌非寄主抗性的主要机制.
卵菌侵染敏感和抗病植物的早期是相同的,只是进入寄主组织后不同.
在敏感寄主植物中,卵菌菌丝分枝进入寄主细胞内形成吸器,从寄主细胞内吸取养分,菌丝通过胞间空隙从侵入点向四周扩展,而抗病寄主植物在侵染点发生HR,且病菌和植物的基因型决定HR发生时间与HR枯斑大小.
有些非亲和互作只有一至几个细胞发生HR(micro2hypersensitiveresis2tance,micro2HR),而有些非亲和互作呈现明显的肉眼可见的枯斑(macro2hypersensitiveresistance,macro2HR),如P.
infestans侵染携带Salanumdemissum抗病基因的马铃薯和其它高抗马铃薯时常在侵染点及周围一些细胞发生过敏性死亡形成枯斑.
也有研究报道,对卵菌具有部分抗性(partialresistance)的植物受其侵染时也呈现HR.
发生过敏反应的细胞可阻止病菌特别是非亲和的专性寄生菌的继续侵染.
不少学者对受P.
infestans侵染的植物细胞进行分析,以便了解植物对Phytophthora非寄主抗性的一些基本机制[1,16].
对P.
infestans免疫的植物如龙葵(Solanumnigrum)、欧芹、烟草和拟南芥等非寄主在侵染点呈现出HR,即程序化细胞死亡(programmedcelldeath,PCD)[1,16],HR只局限于侵染点单个表皮细胞或侵入点附近的一些细胞[1,16],这种HR与植物对P.
infestans可遗传抗性(包括非寄主抗性)相关[1].
已有的几种非寄主抗性模式可以部分地阐述植物的特异性和非特异性抗性[1,6].
植物和病原菌互作中的特异性抗性是基因对基因学说(gene2for2gene)的典型例子[7],但该学说能否适用于非寄主抗性还不683植物病理学报33卷1995-2004TsinghuaTongfangOpticalDiscCo.
,Ltd.
Allrightsreserved.
清楚.
由于植物对病原菌的非寄主抗性和病原菌对植物的毒性缺少量的差异,即植物对病原菌的非寄主抗性和病原菌对植物的毒性往往是质量性状,且寄主与非寄主之间通常存在性不亲和即不能相互杂交,致使经典的遗传方法不能阐明非寄主抗性是否符合基因对基因学说.
但对于疫霉菌,非寄主抗性中普遍存在的HR和非寄主水平上avr基因编码种的特异性激发子符合基因对基因学说,因此植物对疫霉菌的非寄主抗性可能是植物的多个R基因与其相匹配的必要的或多个avr基因相互识别的结果[1].
关于植物对卵菌的非寄主抗性主要有以下几个互作系统.
2.
1欧芹2疫霉菌互作系统P.
sojae和P.
infestans与其非寄主欧芹互作时,植物体内同时发生一系列复杂的形态和生化防卫反应,其细胞最终表现出过敏性死亡[17].
P.
sojae分泌的42kD胞外糖蛋白激发子或来自此蛋白的13个氨基酸的寡肽可诱导欧芹细胞发生一系列反应,如膜透性改变、氧化迸发(oxidativeburst)、防卫基因的诱导表达和防卫物质的积累等[18].
该糖蛋白激发子具有依赖于钙离子的谷胱酰氨转移酶活性,且在Phytoph2thora中高度保守.
突变体分析表明,某些氨基酸残基对激发子和酶活性是必须的,该激发子基因的突变可能导致病原菌适生性和该糖蛋白酶活性的改变[5].
因此,欧芹对疫霉的非寄主抗性可能是由疫霉菌产生的激发子调控的.
欧芹细胞过敏性死亡信号传导机制还不清楚.
最近有报道,几个疫霉种产生的24kD蛋白激发子可诱导欧芹叶片细胞过敏性死亡和植保素的积累,也能诱导非寄主抗性,该蛋白激发子与Fusariumoxysporum产生可诱导非特异性坏死反应蛋白在序列上具有高度同源性[19],它还可诱导包括烟属和拟南芥等其它植物产生类似HR反应症状.
2.
2烟草2疫霉菌互作系统烟草与疫霉菌非亲和互作的研究是了解非寄主抗性的理想体系,深入研究该互作系统的分子机制有利于澄清植物对卵菌非寄主抗性的机理.
过去20多年的研究表明,疫霉菌和部分腐霉菌分泌的分子量为10kD的胞外蛋白激发子elicitin(INF1)是决定烟草对疫霉菌非寄主抗性的关键因子,cryptogein可能与植物原生质膜上的受体结合[20],经过一系列信号传导诱导烟草HR及与防卫反应相关的生化反应[21].
烟属的不同植物对P.
infestans抗性不同,且受其产生的激发子诱发的HR强度也不同[22].
elicitin(INF1)基因缺失的P.
infestans菌株可引起N.
ben2thamiana发病,表明INF1在P.
infestans和N.
ben2thamiana互作中行使无毒因子功能调控烟草对P.
infestans的抗性[16].
然而N.
benthamiana对有些INF1功能正常的P.
infestans菌株敏感,也就是说它不是P.
infestans严格意义上的非寄主,表明在N.
benthamiana2P.
infestans互作系统中除了INF1外还存在其它因子来调控感病和抗病平衡.
最近一个突破性发现是elicitin除了在烟草与疫霉菌非亲和互作中充当信号分子(无毒因子)外,对疫霉菌的生长发育亦有重要作用.
由于疫霉菌自身不能合成甾醇,而elicitin(如cryptogein)可携带甾醇帮助病原菌从寄主体内吸收甾醇.
由此可见,在植物和病原菌长期协同进化过程中,植物通过对病原菌某些胞壁和胞外因子的识别产生了抗病性;同时也说明"无毒基因产物对病原菌是不利的"这种观点可能是不成立的.
最新的基于病毒表达载体的基因组范围内激发子基因筛选技术非常适用高通量功能分析[21],它对检测该互作系统中植物对激发子的反应及其对疫霉菌抗性研究提供了新的思路.
Nicotiana对P.
infestans抗病性的遗传机制可能具有多样性.
有些丧失了产生INF1能力的P.
in2festans菌株仍不能侵染包括普通烟在内的大多数烟属植物,表明这些烟草还可能与P.
infestans产生的其它激发子如elicitin家族的其它成员发生非亲和互作[1].
事实上,该病原菌产生的INF2、INF4、INF5和INF6等elicitin均可诱发烟草不同程度的HR症状.
此外,P.
infestans还可产生与elicitin完全不同的可诱发烟草HR的其它蛋白激发子.
因此全面克隆P.
infestans的elicitin家族所有成员的基因及分析其功能有利于澄清烟草对P.
infestans的非寄主抗性机制.
疫霉菌除了产生10kD的elicitin激发子外,还可产生多种可诱发烟草HR反应的激发子.
Phytophthoramegasperma分泌的32kD糖蛋白可以诱发烟草的HR.
最近本实验室发现棉疫病菌(P.
boehmeriae)除能分泌elicitin外,还能分泌多种可诱发烟草HR的激发子,其中一种是90kD的蛋白激发子,其诱发烟草HR的活性(最低剂量100pmol/L~0.
5nmol/L)比elicitin(10~50nmol/L)高20~100倍,可诱发烟草对真菌、卵菌、细菌和病毒的系统获得抗性[23~25];另一种是32kD的蛋白激发子,也可诱发烟草HR(内部资料).
因此,烟草体内可能存在多个具有不同特异性R基因的复杂遗传控制系统来调控其对Phytophthora的非寄主抗性.
7835期张正光,等:植物对卵菌的非寄主抗病性1995-2004TsinghuaTongfangOpticalDiscCo.
,Ltd.
Allrightsreserved.
2.
3拟南芥2疫霉菌互作系统Peronosporaparasitica和Albugocandida等活体营养卵菌可侵染模式植物拟南芥,但是Phytophthora中只有白菜上的Phytophthoraporri菌株可侵染拟南芥,大多数的疫霉菌如P.
infestans和P.
sojae均不能侵染拟南芥[1,16],而能诱发主动防卫反应,如过敏反应、防卫基因的表达[5].
最近Kamoun等[1]将这些病原菌游动孢子接种拟南芥时出现明显HR,推测拟南芥中可能存在R基因调控HR和对疫霉菌非寄主抗病性.
现已证明,R基因在不同种植物之间的转化可提高植物的抗病性[26],拟南芥基因组计划的完成和一些对疫霉菌的非寄主抗性基因的克隆、测序为研究拟南芥对疫霉菌非寄主抗性的分子机制奠定了基础,将来可望将拟南芥中分离的决定其对疫霉菌非寄主抗性的R基因导入大豆或马铃薯中提高它们对疫霉菌的抗病性.
现在面临的挑战是对现有拟南芥基因组的26000个基因进行鉴定.
因此就功能基因组而言,拟南芥是分析非寄主植物与卵菌复杂互作的最好系统.
3部分抗性研究表明,Solannumspp.
植物对P.
infestans普遍存在部分抗性现象[27].
对P.
infestans引起的HR进行细胞学观察发现,呈现部分抗性的植物在HR枯斑内没有菌丝而周围活的寄主组织中有菌丝存在,这种HR称为滞后过敏反应(trailingHR),植物呈现出部分抗性.
同样地,Botella等[28]在Peronosporaparasitica侵染转RPP12WsB的拟南芥时观察到trailingHR.
提示在某些互作中,弱抗病基因与无毒基因互作或基因剂量效应(gene2dosageeffects)可能导致无效的HR,植物最终表现出部分抗性.
4植物对腐霉菌(Pythium)的抗性Pythium是水和土壤习居菌,与霜霉菌和部分Phytophthora不同,它是非寄生专化性病原菌,能侵染许多植物.
大多数情况下,Pythium是局部侵染,但是当它侵入到植物深层组织进入维管束系统时也可引起寄主植物严重症状如萎蔫.
因此大多数成株植物对Pythium具有部分抗性,病菌只局限侵染表皮或只在苗期侵染,这种抗性不涉及HR,但是它受植物生理屏障和植物激素如茉莉酸、乙烯调控[1].
Vijayan等[29]和Staswick等[30]报道弱寄生腐霉菌P.
mastophorum和P.
irregulare可以侵染拟南芥茉莉酸缺失突变体和茉莉酸不敏感型突变体.
同样转拟南芥etr21基因的烟草植株(含N基因)由于缺乏乙烯受体ETR1而不能产生乙烯介导效应[31],对TMV接种诱发的HR不受影响,但其丧失了对非致病土传菌P.
sylvaticum的非寄主抗性,可见茉莉酸和乙烯调控的防卫系统可能是大多数植物对卵菌表现出部分抗性的基础.
有趣的是茉莉酸调控对Pythium的抗病性途径是不依赖SA调控的[32].
水杨酸及其功能类似物INA(2,62dichloroisonidcotinicacid)可以、而甲基茉莉酸不能诱发拟南芥对P.
parasitica的抗性,且INA可以诱导拟南芥局部细胞出现过敏性死亡.
此外茉莉酸不敏感型拟南芥突变体与野生型植株对P.
parasitica敏感性相同[33].
说明植物的HR和与HR相关的抗病途径对专性寄生病原菌如霜霉菌比对腐霉菌等非专化寄生病菌的抗性更重要.
5过敏反应在植物对卵菌非寄主抗性中的作用过敏反应是植物与病原菌非亲和互作的典型特征.
现有的研究表明植物对疫霉菌、霜霉菌的抗性都与HR相关,根据基因对基因学说观点,病原菌产生的激发子(elicitor)与植物R基因编码的受体直接或间接识别可能调控植物对卵菌的非寄主抗性和部分抗性,因此植物与卵菌非亲和互作产生的HR分子机制和R基因调控的非寄主抗性的潜在作用一直倍受人们关注.
R基因最初是针对avr基因提出来的,很长时期内人们认为R基因离开与其相匹配的avr基因就没有作用,但是后来人们发现非专化性的R基因可能调控持久抗性,且发现植物有多个R基因与其匹配的彼此不相关的avr基因互作共同决定植物对病原菌的非寄主抗性,这种抗性很难克服,因此病原菌必须有多个avr基因突变后才能致病[6].
一个典型的例子是烟草对疫霉菌的非寄主抗性系统中就存在多个激发子[16,23~25,33].
无毒基因编码产物和激发子除了调控非亲和互作外,可能同时具有双重功能,在病原菌对其寄主植物的致病过程中可以发挥毒性因子的作用,参与了病原菌的致病过程或病原菌的生长发育而成为病原菌不可缺少的因子[34,35],因此可以大量栽培含有与该无毒基因对应的抗病基因的品种来防治病害.
番茄叶霉病菌(Cladosporiumfulvum)无毒基因Ecp2的编码产物ECP2是一个重要无毒因子,该基因可能是病原菌必需的,当其突变时,病原菌菌丝的生长、分生孢子的产生均不如野生型菌株[34].
因此大量栽培携带与Ecp2对应的R基因品种有利于检测抗性的持久性.
883植物病理学报33卷1995-2004TsinghuaTongfangOpticalDiscCo.
,Ltd.
Allrightsreserved.
当寄主植物缺少可遗传的持久抗性时,病原菌可能进化成新的小种,而具有部分抗性的植物产生的选择压力不能使整个病菌群体中出现优势种群[36],可见无论是由多个抗病基因还是由其它机制控制,部分抗性可能是一种比较持久的抗性(durableresistance).
6关于非寄主抗性假说非寄主抗性是植物2病原物互作中尚待解决的难题.
最近提出植物对疫霉菌的非寄主抗性模式是,多重基因对基因互作从而形成最初防卫屏障.
但它无法解析非寄主植物如何从特异性抗病性演化成广谱抗病性.
因为基因对基因互作的大多数进化互作中盛行"arms2race"假说,认为在适宜的病原菌胁迫下抗病等位基因迅速进化[36].
现在人们越来越支持"trench2warfare"模式,认为古老的抗病等位基因进化慢,它经历多个"前进2后退"(advancesandretreats)循环,即有人所说的"生2死"(birth2and2death)过程.
该模式认为病原菌群体与植物处于一个协同进化过程中,非寄主抗性可能受一套古老的广谱抗病基因座调控,当植物高频率的抗病等位基因与其相匹配的病原菌高频率的等位无毒基因相作用时就产生非寄主抗性[37,38].
据此认为elicitin是疫霉菌无毒基因编码产物,该无毒基因在疫霉菌核染色体上存在多个拷贝,成簇排列,烟属的大多数种对疫霉菌多种elicitin的识别可能就是通过古老的广谱抗病基因家族的识别来完成的[5].
7结论在卵菌与植物相互作用研究中,非寄主抗病性的重要性越来越受到人们的关注.
最近已鉴定了对霜霉病菌具有广谱抗性的拟南芥基因[37],一些学者正在对疫霉菌具有广谱抗性的基因进行鉴定,这些工作的开展将有利于进一步阐明非寄主抗性机理和控制植物疫病.
此外,非寄主水平上发挥作用的无毒基因的鉴定、对激发子敏感和不敏感植物突变体的鉴定及非寄主抗性中信号传导途径中信号分子的鉴定,将有利于检测对疫霉菌非寄主抗性中的多重特异性反应.
这些研究不仅对认识植物与病原菌协同进化的分子机制有理论价值,同时对改良植物抗病性有重要应用价值.
随着基因组学和分子生物学技术的发展,植物对卵菌的非寄主抗性将可望从以下几方面得到新的突破:1)激发子与相应受体的研究:除以传统的激发子分离到植物结合蛋白鉴定、功能分析外,从以病毒表达载体构建的病原菌cDNA文库中全面筛选克隆激发子基因,阐明激发子和植物互作机理的同时深入了解激发子基因对病原菌的作用;2)突变体研究:激发子不应型突变体的分析可为获得和鉴定激发子受体及其下游信号分子,为阐明植物对卵菌的非寄主抗性分子机制奠定试验基础;3)无毒基因或elicitor基因在植物中的表达有利于鉴定激发子的活性和分析植物对病原菌非寄主抗病性的分子机制,如N.
benthamiana对P.
infestans非寄主抗性研究,阐明卵菌avr基因和elicitor的特征及其在不同抗性类型的作用,对理解小种进化和设计持久的抗卵菌植物基因工程有帮助.
参考文献[1]KamounS,HuitemaE,VleeshouwersVGAA.
Resistancetooomycetes:ageneralroleforthehypersensitiveresponse[J].
TrendsPlantSci.
,1999,4:196-200.
[2]郑小波.
疫霉菌及其研究技术[M].
北京:中国农业出版社,1997.
[3]FryWE,GoodwinSB.
Re2emergenceofpotatoandtomatolateblightintheUnitedStates[J].
PlantDis.
,1997,81:1349-1357.
[4]KnightJ,FranciscoS.
Fearsmountasoakblightinfectsredwoods[J].
Nature,2002,415:251.
[5]KamounS.
NonhostresistancetoPhytophthora:novelprospectsforaclassicalproblem[J].
CurrentOpinioninPlantBiology,2001,4:295-300.
[6]HeathMC.
Nonhostresistanceandnonspecificplantdefenses[J].
Cur2rentOpinioninPlantBiology,2000,3:315-319.
[7]StaskawiczBJ,AusubelFM,BakerBJ,etal.
Moleculargeneticsofplantdiseaseresistance[J].
Science,1995,268:661-667.
[8]vandePeerY,deWachterR.
Evolutionaryrelationshipsamongtheeu2karyoticcrowntaxatakingintoaccountsite2to2siteratevariationin18SrRNA[J].
J.
Mol.
Evol.
,1997,45:619-630.
[9]BaldaufSL,RogerAJ,Wenk2SiefertI,etal.
Akingdom2levelphyloge2nyofeukaryotesbasedoncombinedproteindata[J].
Science,2000,290:972-977.
[10]CookeDE,DrenthA,DuncanJM,etal.
AmolecularphylogenyofPhytophthoraandrelatedoomycetes[J].
FungalGenet.
Biol.
,2000,30:17-32.
[11]GoodwinSB,LegardDE,SmartCD,etal.
GeneflowanalysisofmolecularmarkersconfirmsthatPhytophthoramirabilisandP.
infestansareseparatespecies[J].
Mycologia,1999,91:796-810.
[12]OrdonezME,HohlHR,VelascoJA,etal.
AnovelpopulationofPhytophthora,similartoP.
infestans,attackswildSolanumspeciesinEcuador[J].
Phytopathology,2000,90:197-202.
[13]ReignaultP,FrostLN,RichardsonH,etal.
FourArabidopsisRPPlocicontrollingresistancetotheNoco2isolateofPeronosporaparasiticamaptoregionsknowntocontainotherRPPrecognitionspecificities[J].
Mol.
PlantMicrobeInteract.
,1996,9:464-473.
[14]HudspethDSS,NadlerSA,HudspethMES.
ACOX2molecularphylogenyofthePeronosporomycetes[J].
Mycologia,2000,92:674-684.
9835期张正光,等:植物对卵菌的非寄主抗病性1995-2004TsinghuaTongfangOpticalDiscCo.
,Ltd.
Allrightsreserved.
[15]HermannmHP,PeterRD.
Plant2fungalpathogeninteraction[M].
Berlin:Springer,2001.
[16]KamounS,vanWestP,VleeshouwersVG,etal.
ResistanceofNico2tianabenthamianatoPhytophthorainfestansismediatedbytherecogni2tionoftheelicitorproteinINF1[J].
PlantCell,1998,10:1413-1426.
[17]HahlbrockK,ScheelD,LogemannE,etal.
Oligopeptideelicitor2me2diateddefensegeneactivationinculturedparsleycells[J].
Proc.
Natl.
Acad.
Sci.
USA,1995,92:4150-4157.
[18]NurnbergerT,NennstielD,JabsT,etal.
Highaffinitybindingofafungaloligopeptideelicitortoparsleyplasmamembranestriggersmultipledefenseresponses[J].
Cell,1994,78:449-460.
[19]BaileyBA.
PurificationofaproteinfromculturefiltratesofFusariumoxysporumthatinducesethyleneandnecrosisinleavesofErythroxylumcoca[J].
Phytopathology,1995,85:1250-1255.
[20]WendehenneD,BinetMN,BleinJP,etal.
Evidenceforspecific,high2affinitybindingsitesforaproteinaceouselicitorintobaccoplasmamembrane[J].
FEBSLett.
,1995,374:203-207.
[21]SasabeM,TakeuchiK,KamounS,etal.
Independentpathwaysleadingtoapoptoticcelldeath,oxidativeburstanddefensegeneexpressioninresponsetoelicitinintobaccocellsuspensionculture[J].
Eur.
J.
Biochem.
,2000,267:5005-5013.
[22]BaulcombeDC.
Fastforwardgeneticsbasedonvirus2inducedgenesi2lencing[J].
Curr.
Opin.
PlantBiol.
,1999,2:109-113.
[23]张正光,王源超,郑小波.
棉疫病菌90kD胞外蛋白激发子生物活性与稳定性研究[J].
植物病理学报,2001,31:213-218.
[24]张正光,王源超,郑小波.
一种新的90kD胞外蛋白激发子诱导烟草系统获得抗性研究[J].
植物病理学报,2002,32:338-346.
[25]张正光,王源超,郑小波.
棉疫病菌90kD胞外蛋白激发子诱导烟草过敏性反应的研究[J].
植物病理学报,2003,33:72-76.
[26]WhithamS,McCormickS,BakeB.
TheNgeneoftobaccoconfersre2sistancetotobaccomosaicvirusintransgenictomato[J].
Proc.
Natl.
Acad.
Sci.
USA,1996,93:8776-8781.
[27]ColonLT,BuddingDJ,KeizerLCP,etal.
Componentsofresistancetolateblight(Phytophthorainfestans)ineightSouthAmericanSolanumspecies[J].
Eur.
J.
PlantPathol.
,1995,101:441-456.
[28]BotellaMA,PakerJE,FrostLN,etal.
ThreegenesoftheArabidop2sisRPP1complexresistancelocusrecognizedistinctPeronosporaparasi2ticaavirulencedeterminants[J].
PlantCell,1998,10:1847-1860.
[29]VijayanP,SchockeyJ,LevesqueCA,etal.
AroleforjasmonateinpathogendefenseofArabidopsis[J].
Proc.
Natl.
Acad.
Sci.
USA,1998,95:7209-7214.
[30]StaswickPE,YuenGY,LehmanCC.
JasmonatesignalingmutantsofArabidopsisaresusceptibletothesoilfungusPythiumirregulare[J].
PlantJ.
,1998,15:747-754.
[31]KnoesterM,vanLoonLC,vandeHeuvelJ,etal.
Ethylene2insensi2tivetobaccolacksnonhostresistanceagainstsoilbornefungi[J].
Proc.
Natl.
Acad.
Sci.
USA,1998,95:1933-1937.
[32]ThommaBPHJ,EggermontK,PenninckxIAMA,etal.
Separatejasmonate2dependentandsalicylate2dependentdefense2responsepathwaysinArabidopsisareessentialforresistancetodistinctmicrobialpathogens[J].
Proc.
Natl.
Acad.
Sci.
USA,1998,95:15107-15111.
[33]BaillieulF,GenetetI,KoppM,etal.
Anewelicitorofthehypersensi2tiveresponseintobacco:afungalglycoproteinelicitscelldeath,expres2sionofdefencegenes,productionofsalicylicacid,andinductionofsys2temicacquiredresistance[J].
PlantJ.
,1995,8:551-560.
[34]LaugeR,MatthieuHAJ,JoostenJPW,etal.
Successfulsearchforaresistancegeneintomatotargetedagainstavirulencefactorofafungalpathogen[J].
Proc.
Natl.
Acad.
Sci.
USA,1998,95:9014-9018.
[35]van'tSlotKAE,KnoggeW.
Adualroleformicrobialpathogen2de2rivedeffectorproteinsinplantdiseaseandresistance[J].
CriticalRe2viewsinPlantSciences,2002,21:229-271.
[36]JamesRV,FryWE.
PotentialforPhytophthorainfestanspopulationstoadapttopotatocultivarswithrate2reducingresistance[J].
Phytopatholo2gy,1983,73:984-988.
[37]StahlEA,BishopJG.
Plant2pathogenarmsracesatthemolecularlevel[J].
Curr.
Opin.
PlantBiol.
,2000,3:299-304.
[38]XiaoS,EllwoodS,CalisO,etal.
Broad2spectrummildewresistanceinArabidopsisthalianamediatedbyRPW8[J].
Science,2001,291:118-120.
责任编辑:杨晓昱093植物病理学报33卷1995-2004TsinghuaTongfangOpticalDiscCo.
,Ltd.
Allrightsreserved.
njau.
edu.
cn作者简介:张正光(1972-),男,湖南新邵县人,讲师,博士,主要从事真菌遗传与分子生物学及病原菌与植物互作研究.
植物病理学报ACTAPHYTOPATHOLOGICASINICA33(5):3852390(2003)植物对卵菌的非寄主抗病性张正光,王源超,郑小波3(南京农业大学植保学院,农业部病虫监测与治理重点开放实验室,南京210095)Nonhost2resistanceofplanttooomycetesZHANGZheng2guang,WANGYuan2chao,ZHENGXiao2bo3(TheKeyLabofMonitoringandManagementofPlantDiseasesandInsects,ChinaMinistryofAgriculture,CollegeofPlantProtection,NanjingAgriculturalUniversity,Nanjing210095,China)中图分类号:Q9491323;S43212文献标识码:A文章编号:041220914(2003)0520385206卵菌是多分枝的群体,包括60多种疫霉菌、多个活体营养的霜霉菌和100多种腐霉菌,其中许多是植物病原菌.
卵菌在系统进化上有别于其它植物病原真菌,形成一个独立的群体[1],所致病害给许多农作物和花卉植物造成毁灭性危害[2].
引起爱尔兰饥荒的Phytophthorainfestans现每年给全球造成数十亿美元的损失[3];最近在美国太平洋沿海Phytophthoraramorum侵染橡胶树而造成成片树木突然死亡[4].
100多年来,为了控制该群病原生物所致病害,世界各国的真菌学和植物病理学工作者从不同角度对疫霉菌进行了大量地研究,但由于从寄主植物中难以获得抗性持久的抗源,而且缺乏针对卵菌的有效杀菌剂,因此长期以来人们很难控制卵菌引起的植物病害.
卵菌的寄主范围很广,但不同种卵菌的寄主范围差异很大.
有些卵菌侵染不同种植物时呈现出高度的寄主专化性,如P.
infestans只侵染马铃薯和番茄等少数几种植物而不能侵染其它植物[1].
但是该群生物中不少种的致病力分化不明显,很难从寄主材料中找到抗源,此外专化性抗性基因容易因病原菌的变异而丧失抗性,致使这种病害难以控制,因此对疫霉菌等卵菌的非寄主抗性分子机制倍受人们关注[1,5~7].
非寄主抗病性具有稳定持久的特点,可望用来设计植物的抗卵菌基因工程.
本文综述了卵菌的寄主专化性、基本致病性和植物对卵菌抗性的最新进展及植物与卵菌特别是疫霉菌的非寄主抗性和过敏反应(hypersensitiveresponse,HR)之间的关系.
1卵菌的系统进化关于卵菌的系统进化来源,很长时间内存在着不同的观点.
由于卵菌呈丝状生长,因此人们通常错误地将其视为真菌.
根据生化分析和核糖体RNA序列及线粒体基因序列建立的系统发育树分析表明卵菌与真正的真菌(truefungi)亲源关系较远,是完全不同于丝状真菌的真核植物病原生物,而与原生生物界的金褐藻和不等鞭毛藻(heterokontalgae)亲缘关系更近,是一个具有种的多样性群体,包括侵染动植物的病原菌和一些腐生菌(如水霉)[8].
最近根据线粒体基因编码蛋白和4个保守细胞核基因编码蛋白的氨基酸序列[9]建立的系统发育树亦支持上述结论.
可见,卵菌进化成能侵染植物而与其它植物病原真菌不同的群体可能有自己特殊的机制.
对于卵菌属内不同群体的进化关系,Cooke等[10]利用核糖体DNA转录间隔区ITS(internaltranscribedspacer)对50个疫霉种及相关卵菌的亲源关系进行了研究,发现尽管Phytophthora具有高度的多样性,但仍为一个单系演化群体(monophyleticgroup),即起源于共同的祖先;认为活体营养的专性寄生霜霉菌可能起源于疫霉菌,是Phytophthora和Peronospora长期进化过程中的派生现象,且可能是进化的趋势.
然而疫霉菌对寄主具有较强的适生性,如尽管侵染番茄和马铃薯的P.
infestans与侵染Mirabilisjalapa的Phytoph2thoramirabilis和侵染利马豆的Phytophthoraphaseoli形1995-2004TsinghuaTongfangOpticalDiscCo.
,Ltd.
Allrightsreserved.
图卵菌主要属的进化[5]Fig.
Phylogeneticevolutionaryrelationshipsamongthemajorgeneraofoomycetes[5]成一个单系演化群体[10,11],但是最近有研究报道P.
infestans可侵染多种茄科植物,如野生的茄属植物、矮牵牛和Nicotianabenthamiana[12].
人们通过对卵菌群体内系统发育关系研究后,对卵菌的寄主专化性和致病性的进化有了深入的了解[13,14].
认为卵菌侵染植物的能力在进化过程中最少发生了两次飞跃(图),对植物具有致病性可能最早出现在古老的腐霉科生物,其中包括疫霉属中大多数种,后来Aphanomyces属的一些物种也进化成植物病原菌,这些物种与腐霉科亲源关系较远,而与动物病原菌关系非常密切.
因此腐霉科的物种在卵菌进化早期获得了侵染植物的能力,随后发展成现在的群体;而Aphanomyces属可能在较晚期独立地进化成寄生植物的群体[5].
可见对腐霉科的生物、Aphanomyces及动植物病原菌的基因组比较分析可能有利于鉴定植物病原卵菌与致病性相关的基因.
2植物对卵菌的非寄主抗病性某种植物的所有个体对某种病原菌表现的抗病性称为非寄主抗病性,是植物最主要的抗病类型,这种抗病性不是由植物单个专化性抗病基因控制的,不易随着病原菌的变异而丧失,具有抗性稳定持久的特点[15].
非寄主抗性的机制包括预存性结构屏障、预存毒性化合物以及由于病原菌侵染的诱导使植物产生的诱导型主动抗病反应.
虽然植物预存的结构屏障和毒性化合物如皂苷(主要作用于细胞膜中甾醇)是多数植物病原真菌的主要抗性机制,但是还没有证据表明结构屏障对卵菌具有抗病作用[4].
因为卵菌细胞壁中不含植物皂苷的作用靶子———甾醇,因此植物对该类病原菌的非寄主抗性与其它丝状真菌可能不同,而是由不同的遗传和生化机制调控,其中诱导型主动抗病性可能是植物对卵菌非寄主抗性的主要机制.
卵菌侵染敏感和抗病植物的早期是相同的,只是进入寄主组织后不同.
在敏感寄主植物中,卵菌菌丝分枝进入寄主细胞内形成吸器,从寄主细胞内吸取养分,菌丝通过胞间空隙从侵入点向四周扩展,而抗病寄主植物在侵染点发生HR,且病菌和植物的基因型决定HR发生时间与HR枯斑大小.
有些非亲和互作只有一至几个细胞发生HR(micro2hypersensitiveresis2tance,micro2HR),而有些非亲和互作呈现明显的肉眼可见的枯斑(macro2hypersensitiveresistance,macro2HR),如P.
infestans侵染携带Salanumdemissum抗病基因的马铃薯和其它高抗马铃薯时常在侵染点及周围一些细胞发生过敏性死亡形成枯斑.
也有研究报道,对卵菌具有部分抗性(partialresistance)的植物受其侵染时也呈现HR.
发生过敏反应的细胞可阻止病菌特别是非亲和的专性寄生菌的继续侵染.
不少学者对受P.
infestans侵染的植物细胞进行分析,以便了解植物对Phytophthora非寄主抗性的一些基本机制[1,16].
对P.
infestans免疫的植物如龙葵(Solanumnigrum)、欧芹、烟草和拟南芥等非寄主在侵染点呈现出HR,即程序化细胞死亡(programmedcelldeath,PCD)[1,16],HR只局限于侵染点单个表皮细胞或侵入点附近的一些细胞[1,16],这种HR与植物对P.
infestans可遗传抗性(包括非寄主抗性)相关[1].
已有的几种非寄主抗性模式可以部分地阐述植物的特异性和非特异性抗性[1,6].
植物和病原菌互作中的特异性抗性是基因对基因学说(gene2for2gene)的典型例子[7],但该学说能否适用于非寄主抗性还不683植物病理学报33卷1995-2004TsinghuaTongfangOpticalDiscCo.
,Ltd.
Allrightsreserved.
清楚.
由于植物对病原菌的非寄主抗性和病原菌对植物的毒性缺少量的差异,即植物对病原菌的非寄主抗性和病原菌对植物的毒性往往是质量性状,且寄主与非寄主之间通常存在性不亲和即不能相互杂交,致使经典的遗传方法不能阐明非寄主抗性是否符合基因对基因学说.
但对于疫霉菌,非寄主抗性中普遍存在的HR和非寄主水平上avr基因编码种的特异性激发子符合基因对基因学说,因此植物对疫霉菌的非寄主抗性可能是植物的多个R基因与其相匹配的必要的或多个avr基因相互识别的结果[1].
关于植物对卵菌的非寄主抗性主要有以下几个互作系统.
2.
1欧芹2疫霉菌互作系统P.
sojae和P.
infestans与其非寄主欧芹互作时,植物体内同时发生一系列复杂的形态和生化防卫反应,其细胞最终表现出过敏性死亡[17].
P.
sojae分泌的42kD胞外糖蛋白激发子或来自此蛋白的13个氨基酸的寡肽可诱导欧芹细胞发生一系列反应,如膜透性改变、氧化迸发(oxidativeburst)、防卫基因的诱导表达和防卫物质的积累等[18].
该糖蛋白激发子具有依赖于钙离子的谷胱酰氨转移酶活性,且在Phytoph2thora中高度保守.
突变体分析表明,某些氨基酸残基对激发子和酶活性是必须的,该激发子基因的突变可能导致病原菌适生性和该糖蛋白酶活性的改变[5].
因此,欧芹对疫霉的非寄主抗性可能是由疫霉菌产生的激发子调控的.
欧芹细胞过敏性死亡信号传导机制还不清楚.
最近有报道,几个疫霉种产生的24kD蛋白激发子可诱导欧芹叶片细胞过敏性死亡和植保素的积累,也能诱导非寄主抗性,该蛋白激发子与Fusariumoxysporum产生可诱导非特异性坏死反应蛋白在序列上具有高度同源性[19],它还可诱导包括烟属和拟南芥等其它植物产生类似HR反应症状.
2.
2烟草2疫霉菌互作系统烟草与疫霉菌非亲和互作的研究是了解非寄主抗性的理想体系,深入研究该互作系统的分子机制有利于澄清植物对卵菌非寄主抗性的机理.
过去20多年的研究表明,疫霉菌和部分腐霉菌分泌的分子量为10kD的胞外蛋白激发子elicitin(INF1)是决定烟草对疫霉菌非寄主抗性的关键因子,cryptogein可能与植物原生质膜上的受体结合[20],经过一系列信号传导诱导烟草HR及与防卫反应相关的生化反应[21].
烟属的不同植物对P.
infestans抗性不同,且受其产生的激发子诱发的HR强度也不同[22].
elicitin(INF1)基因缺失的P.
infestans菌株可引起N.
ben2thamiana发病,表明INF1在P.
infestans和N.
ben2thamiana互作中行使无毒因子功能调控烟草对P.
infestans的抗性[16].
然而N.
benthamiana对有些INF1功能正常的P.
infestans菌株敏感,也就是说它不是P.
infestans严格意义上的非寄主,表明在N.
benthamiana2P.
infestans互作系统中除了INF1外还存在其它因子来调控感病和抗病平衡.
最近一个突破性发现是elicitin除了在烟草与疫霉菌非亲和互作中充当信号分子(无毒因子)外,对疫霉菌的生长发育亦有重要作用.
由于疫霉菌自身不能合成甾醇,而elicitin(如cryptogein)可携带甾醇帮助病原菌从寄主体内吸收甾醇.
由此可见,在植物和病原菌长期协同进化过程中,植物通过对病原菌某些胞壁和胞外因子的识别产生了抗病性;同时也说明"无毒基因产物对病原菌是不利的"这种观点可能是不成立的.
最新的基于病毒表达载体的基因组范围内激发子基因筛选技术非常适用高通量功能分析[21],它对检测该互作系统中植物对激发子的反应及其对疫霉菌抗性研究提供了新的思路.
Nicotiana对P.
infestans抗病性的遗传机制可能具有多样性.
有些丧失了产生INF1能力的P.
in2festans菌株仍不能侵染包括普通烟在内的大多数烟属植物,表明这些烟草还可能与P.
infestans产生的其它激发子如elicitin家族的其它成员发生非亲和互作[1].
事实上,该病原菌产生的INF2、INF4、INF5和INF6等elicitin均可诱发烟草不同程度的HR症状.
此外,P.
infestans还可产生与elicitin完全不同的可诱发烟草HR的其它蛋白激发子.
因此全面克隆P.
infestans的elicitin家族所有成员的基因及分析其功能有利于澄清烟草对P.
infestans的非寄主抗性机制.
疫霉菌除了产生10kD的elicitin激发子外,还可产生多种可诱发烟草HR反应的激发子.
Phytophthoramegasperma分泌的32kD糖蛋白可以诱发烟草的HR.
最近本实验室发现棉疫病菌(P.
boehmeriae)除能分泌elicitin外,还能分泌多种可诱发烟草HR的激发子,其中一种是90kD的蛋白激发子,其诱发烟草HR的活性(最低剂量100pmol/L~0.
5nmol/L)比elicitin(10~50nmol/L)高20~100倍,可诱发烟草对真菌、卵菌、细菌和病毒的系统获得抗性[23~25];另一种是32kD的蛋白激发子,也可诱发烟草HR(内部资料).
因此,烟草体内可能存在多个具有不同特异性R基因的复杂遗传控制系统来调控其对Phytophthora的非寄主抗性.
7835期张正光,等:植物对卵菌的非寄主抗病性1995-2004TsinghuaTongfangOpticalDiscCo.
,Ltd.
Allrightsreserved.
2.
3拟南芥2疫霉菌互作系统Peronosporaparasitica和Albugocandida等活体营养卵菌可侵染模式植物拟南芥,但是Phytophthora中只有白菜上的Phytophthoraporri菌株可侵染拟南芥,大多数的疫霉菌如P.
infestans和P.
sojae均不能侵染拟南芥[1,16],而能诱发主动防卫反应,如过敏反应、防卫基因的表达[5].
最近Kamoun等[1]将这些病原菌游动孢子接种拟南芥时出现明显HR,推测拟南芥中可能存在R基因调控HR和对疫霉菌非寄主抗病性.
现已证明,R基因在不同种植物之间的转化可提高植物的抗病性[26],拟南芥基因组计划的完成和一些对疫霉菌的非寄主抗性基因的克隆、测序为研究拟南芥对疫霉菌非寄主抗性的分子机制奠定了基础,将来可望将拟南芥中分离的决定其对疫霉菌非寄主抗性的R基因导入大豆或马铃薯中提高它们对疫霉菌的抗病性.
现在面临的挑战是对现有拟南芥基因组的26000个基因进行鉴定.
因此就功能基因组而言,拟南芥是分析非寄主植物与卵菌复杂互作的最好系统.
3部分抗性研究表明,Solannumspp.
植物对P.
infestans普遍存在部分抗性现象[27].
对P.
infestans引起的HR进行细胞学观察发现,呈现部分抗性的植物在HR枯斑内没有菌丝而周围活的寄主组织中有菌丝存在,这种HR称为滞后过敏反应(trailingHR),植物呈现出部分抗性.
同样地,Botella等[28]在Peronosporaparasitica侵染转RPP12WsB的拟南芥时观察到trailingHR.
提示在某些互作中,弱抗病基因与无毒基因互作或基因剂量效应(gene2dosageeffects)可能导致无效的HR,植物最终表现出部分抗性.
4植物对腐霉菌(Pythium)的抗性Pythium是水和土壤习居菌,与霜霉菌和部分Phytophthora不同,它是非寄生专化性病原菌,能侵染许多植物.
大多数情况下,Pythium是局部侵染,但是当它侵入到植物深层组织进入维管束系统时也可引起寄主植物严重症状如萎蔫.
因此大多数成株植物对Pythium具有部分抗性,病菌只局限侵染表皮或只在苗期侵染,这种抗性不涉及HR,但是它受植物生理屏障和植物激素如茉莉酸、乙烯调控[1].
Vijayan等[29]和Staswick等[30]报道弱寄生腐霉菌P.
mastophorum和P.
irregulare可以侵染拟南芥茉莉酸缺失突变体和茉莉酸不敏感型突变体.
同样转拟南芥etr21基因的烟草植株(含N基因)由于缺乏乙烯受体ETR1而不能产生乙烯介导效应[31],对TMV接种诱发的HR不受影响,但其丧失了对非致病土传菌P.
sylvaticum的非寄主抗性,可见茉莉酸和乙烯调控的防卫系统可能是大多数植物对卵菌表现出部分抗性的基础.
有趣的是茉莉酸调控对Pythium的抗病性途径是不依赖SA调控的[32].
水杨酸及其功能类似物INA(2,62dichloroisonidcotinicacid)可以、而甲基茉莉酸不能诱发拟南芥对P.
parasitica的抗性,且INA可以诱导拟南芥局部细胞出现过敏性死亡.
此外茉莉酸不敏感型拟南芥突变体与野生型植株对P.
parasitica敏感性相同[33].
说明植物的HR和与HR相关的抗病途径对专性寄生病原菌如霜霉菌比对腐霉菌等非专化寄生病菌的抗性更重要.
5过敏反应在植物对卵菌非寄主抗性中的作用过敏反应是植物与病原菌非亲和互作的典型特征.
现有的研究表明植物对疫霉菌、霜霉菌的抗性都与HR相关,根据基因对基因学说观点,病原菌产生的激发子(elicitor)与植物R基因编码的受体直接或间接识别可能调控植物对卵菌的非寄主抗性和部分抗性,因此植物与卵菌非亲和互作产生的HR分子机制和R基因调控的非寄主抗性的潜在作用一直倍受人们关注.
R基因最初是针对avr基因提出来的,很长时期内人们认为R基因离开与其相匹配的avr基因就没有作用,但是后来人们发现非专化性的R基因可能调控持久抗性,且发现植物有多个R基因与其匹配的彼此不相关的avr基因互作共同决定植物对病原菌的非寄主抗性,这种抗性很难克服,因此病原菌必须有多个avr基因突变后才能致病[6].
一个典型的例子是烟草对疫霉菌的非寄主抗性系统中就存在多个激发子[16,23~25,33].
无毒基因编码产物和激发子除了调控非亲和互作外,可能同时具有双重功能,在病原菌对其寄主植物的致病过程中可以发挥毒性因子的作用,参与了病原菌的致病过程或病原菌的生长发育而成为病原菌不可缺少的因子[34,35],因此可以大量栽培含有与该无毒基因对应的抗病基因的品种来防治病害.
番茄叶霉病菌(Cladosporiumfulvum)无毒基因Ecp2的编码产物ECP2是一个重要无毒因子,该基因可能是病原菌必需的,当其突变时,病原菌菌丝的生长、分生孢子的产生均不如野生型菌株[34].
因此大量栽培携带与Ecp2对应的R基因品种有利于检测抗性的持久性.
883植物病理学报33卷1995-2004TsinghuaTongfangOpticalDiscCo.
,Ltd.
Allrightsreserved.
当寄主植物缺少可遗传的持久抗性时,病原菌可能进化成新的小种,而具有部分抗性的植物产生的选择压力不能使整个病菌群体中出现优势种群[36],可见无论是由多个抗病基因还是由其它机制控制,部分抗性可能是一种比较持久的抗性(durableresistance).
6关于非寄主抗性假说非寄主抗性是植物2病原物互作中尚待解决的难题.
最近提出植物对疫霉菌的非寄主抗性模式是,多重基因对基因互作从而形成最初防卫屏障.
但它无法解析非寄主植物如何从特异性抗病性演化成广谱抗病性.
因为基因对基因互作的大多数进化互作中盛行"arms2race"假说,认为在适宜的病原菌胁迫下抗病等位基因迅速进化[36].
现在人们越来越支持"trench2warfare"模式,认为古老的抗病等位基因进化慢,它经历多个"前进2后退"(advancesandretreats)循环,即有人所说的"生2死"(birth2and2death)过程.
该模式认为病原菌群体与植物处于一个协同进化过程中,非寄主抗性可能受一套古老的广谱抗病基因座调控,当植物高频率的抗病等位基因与其相匹配的病原菌高频率的等位无毒基因相作用时就产生非寄主抗性[37,38].
据此认为elicitin是疫霉菌无毒基因编码产物,该无毒基因在疫霉菌核染色体上存在多个拷贝,成簇排列,烟属的大多数种对疫霉菌多种elicitin的识别可能就是通过古老的广谱抗病基因家族的识别来完成的[5].
7结论在卵菌与植物相互作用研究中,非寄主抗病性的重要性越来越受到人们的关注.
最近已鉴定了对霜霉病菌具有广谱抗性的拟南芥基因[37],一些学者正在对疫霉菌具有广谱抗性的基因进行鉴定,这些工作的开展将有利于进一步阐明非寄主抗性机理和控制植物疫病.
此外,非寄主水平上发挥作用的无毒基因的鉴定、对激发子敏感和不敏感植物突变体的鉴定及非寄主抗性中信号传导途径中信号分子的鉴定,将有利于检测对疫霉菌非寄主抗性中的多重特异性反应.
这些研究不仅对认识植物与病原菌协同进化的分子机制有理论价值,同时对改良植物抗病性有重要应用价值.
随着基因组学和分子生物学技术的发展,植物对卵菌的非寄主抗性将可望从以下几方面得到新的突破:1)激发子与相应受体的研究:除以传统的激发子分离到植物结合蛋白鉴定、功能分析外,从以病毒表达载体构建的病原菌cDNA文库中全面筛选克隆激发子基因,阐明激发子和植物互作机理的同时深入了解激发子基因对病原菌的作用;2)突变体研究:激发子不应型突变体的分析可为获得和鉴定激发子受体及其下游信号分子,为阐明植物对卵菌的非寄主抗性分子机制奠定试验基础;3)无毒基因或elicitor基因在植物中的表达有利于鉴定激发子的活性和分析植物对病原菌非寄主抗病性的分子机制,如N.
benthamiana对P.
infestans非寄主抗性研究,阐明卵菌avr基因和elicitor的特征及其在不同抗性类型的作用,对理解小种进化和设计持久的抗卵菌植物基因工程有帮助.
参考文献[1]KamounS,HuitemaE,VleeshouwersVGAA.
Resistancetooomycetes:ageneralroleforthehypersensitiveresponse[J].
TrendsPlantSci.
,1999,4:196-200.
[2]郑小波.
疫霉菌及其研究技术[M].
北京:中国农业出版社,1997.
[3]FryWE,GoodwinSB.
Re2emergenceofpotatoandtomatolateblightintheUnitedStates[J].
PlantDis.
,1997,81:1349-1357.
[4]KnightJ,FranciscoS.
Fearsmountasoakblightinfectsredwoods[J].
Nature,2002,415:251.
[5]KamounS.
NonhostresistancetoPhytophthora:novelprospectsforaclassicalproblem[J].
CurrentOpinioninPlantBiology,2001,4:295-300.
[6]HeathMC.
Nonhostresistanceandnonspecificplantdefenses[J].
Cur2rentOpinioninPlantBiology,2000,3:315-319.
[7]StaskawiczBJ,AusubelFM,BakerBJ,etal.
Moleculargeneticsofplantdiseaseresistance[J].
Science,1995,268:661-667.
[8]vandePeerY,deWachterR.
Evolutionaryrelationshipsamongtheeu2karyoticcrowntaxatakingintoaccountsite2to2siteratevariationin18SrRNA[J].
J.
Mol.
Evol.
,1997,45:619-630.
[9]BaldaufSL,RogerAJ,Wenk2SiefertI,etal.
Akingdom2levelphyloge2nyofeukaryotesbasedoncombinedproteindata[J].
Science,2000,290:972-977.
[10]CookeDE,DrenthA,DuncanJM,etal.
AmolecularphylogenyofPhytophthoraandrelatedoomycetes[J].
FungalGenet.
Biol.
,2000,30:17-32.
[11]GoodwinSB,LegardDE,SmartCD,etal.
GeneflowanalysisofmolecularmarkersconfirmsthatPhytophthoramirabilisandP.
infestansareseparatespecies[J].
Mycologia,1999,91:796-810.
[12]OrdonezME,HohlHR,VelascoJA,etal.
AnovelpopulationofPhytophthora,similartoP.
infestans,attackswildSolanumspeciesinEcuador[J].
Phytopathology,2000,90:197-202.
[13]ReignaultP,FrostLN,RichardsonH,etal.
FourArabidopsisRPPlocicontrollingresistancetotheNoco2isolateofPeronosporaparasiticamaptoregionsknowntocontainotherRPPrecognitionspecificities[J].
Mol.
PlantMicrobeInteract.
,1996,9:464-473.
[14]HudspethDSS,NadlerSA,HudspethMES.
ACOX2molecularphylogenyofthePeronosporomycetes[J].
Mycologia,2000,92:674-684.
9835期张正光,等:植物对卵菌的非寄主抗病性1995-2004TsinghuaTongfangOpticalDiscCo.
,Ltd.
Allrightsreserved.
[15]HermannmHP,PeterRD.
Plant2fungalpathogeninteraction[M].
Berlin:Springer,2001.
[16]KamounS,vanWestP,VleeshouwersVG,etal.
ResistanceofNico2tianabenthamianatoPhytophthorainfestansismediatedbytherecogni2tionoftheelicitorproteinINF1[J].
PlantCell,1998,10:1413-1426.
[17]HahlbrockK,ScheelD,LogemannE,etal.
Oligopeptideelicitor2me2diateddefensegeneactivationinculturedparsleycells[J].
Proc.
Natl.
Acad.
Sci.
USA,1995,92:4150-4157.
[18]NurnbergerT,NennstielD,JabsT,etal.
Highaffinitybindingofafungaloligopeptideelicitortoparsleyplasmamembranestriggersmultipledefenseresponses[J].
Cell,1994,78:449-460.
[19]BaileyBA.
PurificationofaproteinfromculturefiltratesofFusariumoxysporumthatinducesethyleneandnecrosisinleavesofErythroxylumcoca[J].
Phytopathology,1995,85:1250-1255.
[20]WendehenneD,BinetMN,BleinJP,etal.
Evidenceforspecific,high2affinitybindingsitesforaproteinaceouselicitorintobaccoplasmamembrane[J].
FEBSLett.
,1995,374:203-207.
[21]SasabeM,TakeuchiK,KamounS,etal.
Independentpathwaysleadingtoapoptoticcelldeath,oxidativeburstanddefensegeneexpressioninresponsetoelicitinintobaccocellsuspensionculture[J].
Eur.
J.
Biochem.
,2000,267:5005-5013.
[22]BaulcombeDC.
Fastforwardgeneticsbasedonvirus2inducedgenesi2lencing[J].
Curr.
Opin.
PlantBiol.
,1999,2:109-113.
[23]张正光,王源超,郑小波.
棉疫病菌90kD胞外蛋白激发子生物活性与稳定性研究[J].
植物病理学报,2001,31:213-218.
[24]张正光,王源超,郑小波.
一种新的90kD胞外蛋白激发子诱导烟草系统获得抗性研究[J].
植物病理学报,2002,32:338-346.
[25]张正光,王源超,郑小波.
棉疫病菌90kD胞外蛋白激发子诱导烟草过敏性反应的研究[J].
植物病理学报,2003,33:72-76.
[26]WhithamS,McCormickS,BakeB.
TheNgeneoftobaccoconfersre2sistancetotobaccomosaicvirusintransgenictomato[J].
Proc.
Natl.
Acad.
Sci.
USA,1996,93:8776-8781.
[27]ColonLT,BuddingDJ,KeizerLCP,etal.
Componentsofresistancetolateblight(Phytophthorainfestans)ineightSouthAmericanSolanumspecies[J].
Eur.
J.
PlantPathol.
,1995,101:441-456.
[28]BotellaMA,PakerJE,FrostLN,etal.
ThreegenesoftheArabidop2sisRPP1complexresistancelocusrecognizedistinctPeronosporaparasi2ticaavirulencedeterminants[J].
PlantCell,1998,10:1847-1860.
[29]VijayanP,SchockeyJ,LevesqueCA,etal.
AroleforjasmonateinpathogendefenseofArabidopsis[J].
Proc.
Natl.
Acad.
Sci.
USA,1998,95:7209-7214.
[30]StaswickPE,YuenGY,LehmanCC.
JasmonatesignalingmutantsofArabidopsisaresusceptibletothesoilfungusPythiumirregulare[J].
PlantJ.
,1998,15:747-754.
[31]KnoesterM,vanLoonLC,vandeHeuvelJ,etal.
Ethylene2insensi2tivetobaccolacksnonhostresistanceagainstsoilbornefungi[J].
Proc.
Natl.
Acad.
Sci.
USA,1998,95:1933-1937.
[32]ThommaBPHJ,EggermontK,PenninckxIAMA,etal.
Separatejasmonate2dependentandsalicylate2dependentdefense2responsepathwaysinArabidopsisareessentialforresistancetodistinctmicrobialpathogens[J].
Proc.
Natl.
Acad.
Sci.
USA,1998,95:15107-15111.
[33]BaillieulF,GenetetI,KoppM,etal.
Anewelicitorofthehypersensi2tiveresponseintobacco:afungalglycoproteinelicitscelldeath,expres2sionofdefencegenes,productionofsalicylicacid,andinductionofsys2temicacquiredresistance[J].
PlantJ.
,1995,8:551-560.
[34]LaugeR,MatthieuHAJ,JoostenJPW,etal.
Successfulsearchforaresistancegeneintomatotargetedagainstavirulencefactorofafungalpathogen[J].
Proc.
Natl.
Acad.
Sci.
USA,1998,95:9014-9018.
[35]van'tSlotKAE,KnoggeW.
Adualroleformicrobialpathogen2de2rivedeffectorproteinsinplantdiseaseandresistance[J].
CriticalRe2viewsinPlantSciences,2002,21:229-271.
[36]JamesRV,FryWE.
PotentialforPhytophthorainfestanspopulationstoadapttopotatocultivarswithrate2reducingresistance[J].
Phytopatholo2gy,1983,73:984-988.
[37]StahlEA,BishopJG.
Plant2pathogenarmsracesatthemolecularlevel[J].
Curr.
Opin.
PlantBiol.
,2000,3:299-304.
[38]XiaoS,EllwoodS,CalisO,etal.
Broad2spectrummildewresistanceinArabidopsisthalianamediatedbyRPW8[J].
Science,2001,291:118-120.
责任编辑:杨晓昱093植物病理学报33卷1995-2004TsinghuaTongfangOpticalDiscCo.
,Ltd.
Allrightsreserved.
ManSora:英国CN2 VPS,1核/1GB内存/10GB SSD/1TB流量/100Mbps/KVM,$18.2/月
mansora怎么样?mansora是一家国人商家,主要提供沪韩IEPL、沪日IEPL、深港IEPL等专线VPS。现在新推出了英国CN2 KVM VPS,线路为AS4809 AS9929,可解锁 Netflix,并有永久8折优惠。英国CN2 VPS,$18.2/月/1GB内存/10GB SSD空间/1TB流量/100Mbps端口/KVM,有需要的可以关注一下。点击进入:mansora官方网站地址m...
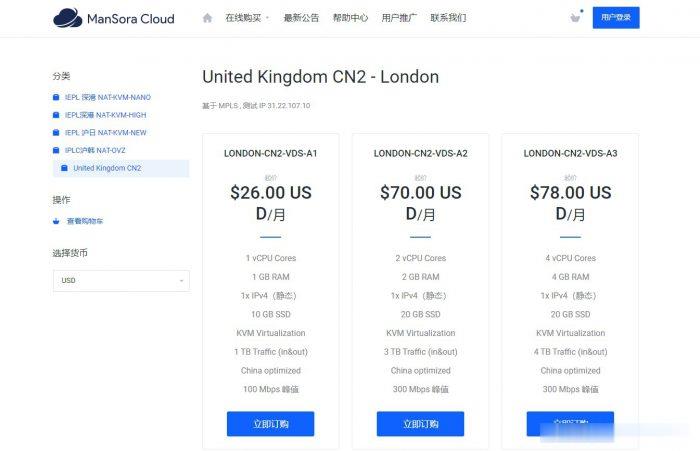
spinservers:圣何塞10Gbps带宽服务器月付$109起,可升级1Gbps无限流量
spinservers是Majestic Hosting Solutions LLC旗下站点,主营国外服务器租用和Hybrid Dedicated等,数据中心在美国达拉斯和圣何塞机房。目前,商家针对圣何塞部分独立服务器进行促销优惠,使用优惠码后Dual Intel Xeon E5-2650L V3(24核48线程)+64GB内存服务器每月仅109美元起,提供10Gbps端口带宽,可以升级至1Gbp...

GigsGigsCloud($26/年)KVM-1GB/15G SSD/2TB/洛杉矶机房
GigsGigsCloud新上了洛杉矶机房国际版线路VPS,基于KVM架构,采用SSD硬盘,年付最低26美元起。这是一家成立于2015年的马来西亚主机商,提供VPS主机和独立服务器租用,数据中心包括美国洛杉矶、中国香港、新加坡、马来西亚和日本等。商家VPS主机基于KVM架构,所选均为国内直连或者优化线路,比如洛杉矶机房有CN2 GIA、AS9929或者高防线路等。下面列出这款年付VPS主机配置信息...
内存的作用为你推荐
-
国内域名注册。中国域名都在哪里可以注册?域名空间代理哪里的域名空间商比较好?已备案域名查询如何快速查询已备案域名并抢注国内ip代理全国各省代理IP台湾主机台湾的电脑硬件比韩国,日本,美国强?免费域名空间免费空间和免费域名域名备案域名需要备案吗?香港虚拟空间香港虚拟空间 好不、现在还有人买嘛虚拟空间哪个好虚拟内存一般设多大比较好?虚拟主机软件问虚拟主机用什么版本的软件比较好