抑制剂便宜外挂官网
1药源快讯YAOYUANPHARMA&BIOTECHWEEKLYwww.
yypharm.
cnPublishedbyYAOYUANwww.
yypharm.
cnVolume2,IssueNo.
2February2014本期主要目录谈新药研发2守株待兔是否可以作为一个合理的研发策略2Sabry原则:兼谈了解机理的重要性2一种鉴定靶点的新技术3热门药物靶点4免疫哨卡抑制剂的前生后世4从PD-1抑制剂MK-3475看新药研发的国际竞争5临床快讯4强生Imbruvica获FDA批准治疗慢性淋巴细胞白血病(CLL)6Gilead固定剂量的ledipasvir/sofosbuvir复方片剂在美申报上市,治疗基因1型成人丙型肝炎6注射抗凝剂cangrelor凶多吉少7双药记:dacomitinib和afatinib8一人得道,鸡犬依旧:PI3K通路抑制剂的艰难历程兼谈理性药物研发的窘境8Palbociclib的二期临床PALOMA实验完成,辉瑞公布其积极结果9企业要闻强生宣布通过耶鲁大学公布临床数据102013年裁员最多的十个制药公司11仿制药经验交流从Dr.
Reddy's的高速发展谈中国仿制药企业的扩张机遇13生物仿制药的欧洲市场经验15药源观点2013年最失败的10个晚期临床开发162守株待兔是否可以作为一个合理的策略2014年2月17日根据成语字典,"守株待兔"比喻不想努力,而希望通过侥幸获得成功.
有句话叫"一次偶然的成功比失败还可怕",指的就说有些人会把守株待兔当作一个取胜策略.
一般来说这被认为是个愚蠢的做法,但难道守株待兔在所有情况下都是最差选择吗对猎人来说守株待兔只有在兔子跑的足够慢、树不是很多、能见度较好、枪法足够好时才是比用枪瞄准射击更愚蠢的策略.
如果兔子跑得比子弹还快、或者天黑的伸手不见五指、或自己喝多了连枪都拿不起来,多种几棵树等着兔子来撞可能比所谓的有的放矢更有效.
新药研发基本属于后一种情况,所以守株待兔在新药研发领域完全可以成为一个真正的策略.
生物体系的复杂程度远远超过现在的技术能力,除了少数例外如感染我们现有的先导物优化指标和疾病几乎没有什么关联,这相当于在黑夜中用比兔子还慢的子弹去打兔子,其成功率可想而知.
偶尔打着几只兔子也不知是怎么打着的.
比如最近火爆的Idelalisib是作为免疫疾病药物在临床前研究中发明的,但意外发现有很好的抗癌作用.
如果把它用现在抗癌药的临床前优化程序评价,这哥们都得拿0分,根本没有上临床的可能.
DPP4抑制剂是最近10年最重要的一类药物,但临床前DPP4抑制剂的疗效并不是很好,比很多后来失败的药物效果都差.
他汀类药物的设计理念是通过抑制HMGCoA还原酶来抑制胆固醇的生物合成从而降低LDL,进而减少胆固醇在动脉血管蓄积而降低心梗.
他汀确实能降低心梗风险,但降低LDL主要原因不是抑制HMGCoA还原酶而是增加LDL受体表达,而降低LDL也没有减少胆固醇血管蓄积,而是减少蓄积物崩解(可能是通过抗炎机理).
而这些例子并非特例,据多个资深研发专家回忆,几乎所有创新药物在研发中都有某些时刻险些被终止.
延续打兔子的比喻就是所有被打中的兔子在被打中之前都曾被怀疑是否是个兔子,但猎人还是开了枪.
既然兔子跑得那么快,我们枪法也不咋地,光线也不好,子弹又那么贵我们应该怎么办呢守株待兔这时可以成为策略之一,具体办法就是多种几棵树,常看看是否有兔子撞在上面.
翻译成术语就是增加临床研究投入,给临床医生时间和经费做一些科研工作,培训医生发现、识别、跟踪可靠的临床发现.
据统计,高达30%的上市药物发现的关键一步是临床前或临床的偶然发现.
如果有机制能显著增加这种发现显然会增加新药的产出.
但遗憾的是这里面困难重重.
医生在越来越多的监管要求下时间越来越少,医疗开支的上升也令他们在经济上无法承受过多的研究投入,政府部门对临床研究的重视程度也不够,企业在资助方面受到的限制也很多,容易被当作标签外推广.
另一个解决现在研发效率的对策是多样化.
除了多种树和苦练枪法外还可以增加其它的打猎办法.
既然现有的研发模式不可持续,我们又不知哪个策略会成功,那就给更多的新策略一些机会.
前一段Linkedin上有一个热烈的讨论,如果你有50亿美元你如何用这些钱搞新药研发.
作者给出三个选择,一是按现有模式,给~5%的回报,二是到市场上收购新产品,三是开始50个完全新颖、互不相关的新项目,虽然美国项目成功率很低(~2%)但其中一个成功的机会较大(64%).
虽然这些数字有很大主观成分,但第三个策略确实有很大吸引力.
我们知道只用枪的成功率太低,多种树也有很多阻碍,那刀枪剑戟一起用,陷阱暗器全都上或许能增加抓到兔子的机会.
Sabry原则:兼谈了解机理的重要性2014年2月4日今天读到一篇文章提到Sabry原则,源自基因泰克的一位研发高管JamesSabry.
这个规则说除非有机理相关的生物标记否则一个项目不应开始临床开发.
这个规则没有Lipinski的5规则有名,可能只反映基因泰克的研发理念.
但基因泰克是历史上最成功的研发公司之一,所以或许这个规则值得我们认真思考一下.
找到机理相关的生物标记首先得知道机理,难道机理未知的药物都不应该到临床开发了基因泰克作为一个以开发抗体药物为核心的企业,当然多数项目都是机理已知的(据我所知尚未有机理未知的抗体药物),而他们抗体药物的巨大成功肯定也会影响他们小分子药物的研发策略.
关键是这个理念对整个药物研发意义有多大,机理未知是多大的风险.
机理是否重要业界意见不一.
有人认为机体太复杂,无法有效根据机理设计药物.
机理未知也不容易被其它企业跟踪me-too,所以竞争上占优势.
在现在研发经费向机理为中心模式高度倾斜的情况下机理未知的新药依然占很大比例也说明机理未必是药物成功的先决条件.
当然更多的人认为机理和其生物标记相当于你半夜下楼时的楼梯把手,扶着它楼梯虽复杂你摔跤的可能性也大大下降,所以了解机理可以降低整个研发过程的风险.
新药研发比黑灯下楼复杂无数倍,失败比摔一跤痛苦无数倍,所以如果知道机理能降低失败率当然花精力找到这个机理是值得的,但实际情况是否是这样呢除了罗氏Swanney的那篇NatureRe-view文章,好像没有真正的数据分析机理在药物研发中的作用.
现在没有系统的数据证明机理未知一定失败率高,或者机理已知就增加成功可能.
那为什么多数人会坚信机理如此重要呢第一我认为很多重要项目的失败可以归罪于机理的未知或错误使用.
2008年著名的阿尔茨海默药物dimebon,辉瑞除了知道它在俄国的一个实验疗效不错之外几乎对它一无所知,结果三期临床失败你根本不知到底哪出的问题.
如果知道机理,至少可以谈新药研发www.
yypharm.
cn3挑选那些从机理上看更有可能应答的人群,或根据生物标记数据更科学地选择剂量.
2006年一个CD28抗体由于错误计算受体占有率(人和猴子的受体表达水平不同)结果剂量过高,导致6个一期临床志愿者全部进了ICU,公司因此破产.
这只是受体表达水平差异的计算失误,如果根本不知是什么机理你更没有机会估计正确的剂量.
最近DMD药物Drisaspersen的失败也是因为二期临床生物标记没有显著改善就进入三期临床而承担了不必要的风险.
第二个原因,我认为是更根本的原因,就是已有的不需要机理信息的筛选优化模型已经过了黄金时期,能找到的药基本找的差不多了,再向未知扩展必须有一定的依据.
机理未知药物主要集中在中枢神经系统,现在多数企业已经离开这个领域,所以以后产出自然会下降.
虽然没有证据了解机理可以降低总风险,但有些具体风险的解除必须依赖机理,比如寻找合适的治疗人群,剂量.
拿现在白热化竞争的PD-1来说,哪个肿瘤、已经用过何种治疗药物的肿瘤PD-1过度表达、过度表达到何种程度是你选择关键3期临床的重要根据.
如果选错了,很容易浪费几个月的宝贵时间,而这几个月将决定你第一还是第二上市.
在现在的支付环境下这几个月可能会造成几十亿美元的销售区别.
人和动物同一蛋白结构和表达水平可以相差很大,甚至人有的动物根本没有或动物有的人没有.
如果动物和人的蛋白有区别,在研究阶段就得寻找在这两种蛋白都有活性的化合物.
否则你可能找个特效老鼠抗癌药.
在对药物附加价值的要求日益增加的环境下,更早地对药物机理的深入理解是寻找有区分药物的保证.
最近辉瑞的研发人员提出新药项目的三个支柱,即药物需要在靶标组织有足够时间浓度达到治疗浓度,显示的确和靶标蛋白结合,并且药理结果和药物机理一致.
这和Sabry规则不谋而合.
当然知道机理并不能保证你成功,而且当机理为中心成为主流后这个模式失败的项目自然会增加,因为项目总数增加了.
但是90%的机理已知药物最后失败并不能说明机理未知成功率会更高.
阿司匹林的成功同样不能说明机理是否清楚无所谓,现在研发成本和审批严格程度都远比阿司匹林时代高,即使微小的成功率区分也可能导致截然不同的后果.
一个失败就可以令小公司破产,大公司元气大伤.
可谓差之毫厘,谬之千里.
现在的重要药物很少是机理未知的.
Sabry规则的核心目的是控制研发风险,并不是说机理未知的药物一定不能成功,只是有些人认为这个风险太大,不值得冒.
这就跟网恋一样.
有没有成功的,肯定有,但多数人认为这是风险很大的一个交友方式.
一种鉴定靶点的新技术2014年2月5日昨天我们讲了Sabry法则和找到靶点的重要性,现在绝对主流的研发模式是从一个确定的靶点开始研发项目,这时就没有必要寻找靶点了因为靶点是已知的.
但也有一些项目是通过临床使用发现意外疗效,或对整体动物尤其是细胞的特殊生物作用而开始的,这时为了在临床甚至临床前开发时遵守Sabry法则,找到靶点就很关键了.
那么在实际工作中如何知道一个有疗效的化合物是作用于哪个蛋白靶点呢找到一个有效化合物的靶点通常很复杂,尤其是表达不多的蛋白(而偏偏调控蛋白一般表达低于维持细胞基本功能的那些蛋白)或镶嵌在细胞膜里的蛋白.
常用的方法是把你有效的化合物接在树脂上然后把细胞打碎后的蛋白混合物浇在树脂上,洗洗涮涮之后理论上和你化合物作用最强的蛋白应该留在树脂上.
然后再用过量的化合物把蛋白从树脂上替换下来,通过质谱或凝胶鉴定此蛋白姓字名谁.
这一期《NatureChemicalBiology》有一篇文章介绍一种新方法,叫做基于活性的蛋白鉴定(activitybasedproteinprofiling,ABPP)方法.
这个方法只能用不可逆配体,即你的活性化合物必须得和作用蛋白发生化学反应,所以这个方法对于含有巯基的水解酶很适用.
鉴定过程是这样的.
首先你要通过细胞筛选一个化合物库.
这个化合物库是由能和巯基反应的化合物组成.
作者观察的细胞变化是脂蓄积,找到若干能促进脂肪蓄积的化合物后,作者开始找哪个蛋白是这些活性化合物的靶点.
他们先把细胞的蛋白混合物和其中一个活性化合物反应,靶点蛋白因为和这个化合物结合强所以基本都和这个化合物形成共价结合物而其它水解酶则基本不和这个化合物反应.
然后作者又用一个荧光标记的和所有水解酶都反应的化合物和这个蛋白混合物反应,因为靶点蛋白已经和活性化合物反应了,所以应该不会被荧光标记.
在凝胶板上和对照一比没有荧光的那个蛋白就是靶点.
另一个鉴定办法是上述步骤的第二部用生物素标记的水解酶抑制剂处理已经和活性化合物反应的蛋白混合物.
然后用抗生物素蛋白树脂把所有含生物素的蛋白挑出,剩下的蛋白用质谱鉴定后既是靶点蛋白.
作者用这个方法找到两个和脂代谢有关的水解酶CES3和CES1F,继续根据这两个靶点优化这些先导物后作者找到一个可以在动物缓解代谢综合症的化合物.
非常优秀的工作.
谈新药研发www.
yypharm.
cn4免疫哨卡抑制剂的前生后世2014年2月12日最近免疫哨卡抑制剂,尤其是PD-1抑制剂迅速成为制药工业最炙手可热的项目.
今天ISI集团分析家MarkSchoenebaum调查显示PD-1抑制剂以绝对优势成为投资者最关注的新药项目.
据估计免疫疗法如果成功可能成为年销售近1000亿美元的豪门望族.
那么免疫哨卡抑制剂是一直这么热门吗我们是否能预测下一个和免疫哨卡抑制剂一样的优质靶点现在虽有施贵宝、默克、罗氏、阿斯列康等大药厂参与竞争,但如果10年前免疫疗法的价值能被准确预见,现在应该有更多的厂家在这个领域厮杀.
正象大多数超大产品一样,免疫哨卡抑制剂也是经过九九八十一难才练成今天的圣果.
免疫疗法历史极其悠久.
1850年,德国医生发现有癌症患者在被感染后有时肿瘤会缩小,所以认为免疫系统可以杀死肿瘤细胞.
当时正是疫苗刚刚开始的时候,但肿瘤细胞粗提物作为癌症疫苗基本无效.
1891年,美国医生WilliamColey用细菌诱导免疫系统杀死肿瘤,取得一定效果.
但此后的100多年免疫疗法的进展较为缓慢,免疫疗法这个概念也逐渐和失败联系在一起.
直到1992年,第一个肿瘤免疫药物T细胞生长因子IL-2才被批准治疗转移性肾癌.
免疫疗法和传统的化疗有本质区别.
如果把癌细胞比作一个犯罪份子,传统抗癌药好比医生派到病人体内去刺杀这个罪犯的一个特工.
但实际上人体就有自己的警察局,这就是免疫系统.
只要这个警察局警力足够并能找到癌细胞这个罪犯,就不一定需要外面来的特工.
癌细胞由于多种变异所以很多具有免疫原性,所以理论上应该可以被免疫系统识别并吞噬.
但如果你更进一步了解一下免疫系统,这比警察抓罪犯要复杂很多.
很多事件要同时发生才能达到治疗效果.
比如抗原的特异性要足够高否则正常细胞也会受到攻击,免疫耐受不太强以至灭活T细胞,肿瘤微环境的免疫抑制特性能被克服等.
早期的思路是增强警力,即用所谓的癌症疫苗增加免疫系统活性,但这个策略是否能产生足够数量和活性的T细胞也是个很大的问号.
最有名的当属前列腺癌药物Provenge.
这个药2007年把其厂家Dendreon变成当年纳斯达克的过山车,暴涨暴跌令投资者备受折磨.
最后虽然上市但只对少数病人有效,而且使用非常不方便,现在公司处于破产边缘.
诺华也正在开发类似药物CTL019.
后来发现免疫系统并不是警力不足而是狡猾的癌细胞在利用警察同志对人民群众的克制来迷惑免疫系统,激活免疫哨卡就是办法之一.
这些免疫哨卡在和配体结合后告诉免疫系统不要乱开枪,而很多癌细胞表达大量免疫哨卡配体使之不受免疫T细胞攻击.
第一个上市的免疫哨卡抑制剂是CTLA-4抑制剂ipilimumab(Yervoy),CTLA-4不仅在癌细胞表达,很多正常细胞也表达,所以早期很多人怀疑这个策略的治疗窗口不够.
后来发现部分抑制CTLA-4可以获得足够的窗口.
Yervoy是少数几个在人体疗效好于动物模型的抗癌药,可以想象Yervoy在临床前和那些小鼠抗癌药比较时的窘境.
在动物模型Yervoy的单方疗效很差,需要与其它药物联用才能起效.
但在病人Yervoy单独使用即有疗效,能显著延长生存期,但有较为严重的肺部感染副作用.
PD-1是另一个免疫哨卡,而很多肿瘤尤其是黑色素瘤和肺癌有很高比例表达其配体PD-L1.
但是早期的研究表明PD-L1和肿瘤的发展和治疗关系复杂,有的研究说PD-L1表达和不良预后正相关、有的则说是负相关、也有研究说二者无关联.
这是和不同肿瘤、肿瘤不同阶段、受过哪些治疗有关,另一方面也和PD-L1的测量手段和截止数值有关(现在公认的过度表达截止数值是25%).
免疫哨卡抑制剂还有一个复杂的地方,即肿瘤对这类药物比其它疗法反应慢,有时甚至肿瘤暂时增大(由于免疫细胞在肿瘤组织的蓄积)然后才缩小.
但由于不是所有病人都应答,这就令临床实验十分困难.
如果病人肿瘤增长是病人对药物不应答还是T细胞蓄积所致病人是否应该继续实验总之当时PD-1在肿瘤的治疗潜力十分模糊,加上昨天讲到的免疫疗法的共有缺陷,几年前有很多人认为这不是一个好靶点,可能最好的结局是能对黑色素瘤这样有一定免疫成分的肿瘤有一定作用.
另外虽然Yervoy成功上市,但比Yervoy稍早的同类药物tremelimumab因为剂量失误并没有显示生存疗效,所以到底Yervoy是个幸运意外还是整个哨卡抑制剂的先头兵当时还很不明确,因此PD-1在当时抗癌药的靶点大军中也并太不起眼.
今天UCSF的LarryFong教授谈到免疫哨卡抑制剂时说"forthelongesttime,peopledidn'tbelievethiswaspossi-ble".
但2012年的ASCO年会上公布了nivolumab的肺癌疗效数据,成了这个领域的一个关键转折点,从此PD-1迅速成为万众瞩目的热门靶点.
前几天我们讲过默克仅今年一年就可能在其PD-1抑制剂lambrolizumab上花费40亿美元开发经费,迅速和5、6个大小公司建立合作关系.
现在PD-1俨然成为癌症患者的最大希望,但新药研发历史表明现在这样大规模的复方组合实验不太可能都能显示疗效.
甚至有人质疑制药公司正在过度开发PD-1抑制剂,很多复方组合没有什么科学根据,使病人成了实验品.
最合理的组合应该是两个免疫哨卡抑制剂或对PD-L1表达正常的肿瘤与肿瘤疫苗联用,但现在的组合已经超出这个范畴.
另一个复杂因素是现在病人对PD-1抑制剂寄予极大希望,所以临床实验几乎必须允许在对照组恶化的病人从对照组向用药组转移,这样总生存率的差别将无法检测.
今天一位叫Thomas热门药物靶点www.
yypharm.
cn5McLaughlin的黑色素瘤患者去世.
四年前他和堂兄的故事曾被《纽约时报》报道.
Thomas在Vemurafenib的临床实验中被分在用药组,而其堂兄被分在对照组.
虽然其堂兄明显在恶化但仍未允许使用Vemurafenib,结果提前去世.
这在当时引起很大伦理争议.
但反过来如果允许组间交换我们永远不会知道Vemurafenib是否延长病人寿命.
PD-1抑制剂面临同样伦理困境.
PD-1抑制剂展现了现在新药研发,尤其是大项目的一个趋势.
在临床概念验证之前,千里马和众多普通马一个槽吃食,谁也分不出哪个是千里马.
年初有一篇文章分析近年800多个制药公司的研发情况,发现70%的二期临床药物不能进入三期,说明我们对靶点质量的判断能力实在目不忍睹.
如果考虑很多意外发现成了上市药物(即大家并未认为这些药物有治疗功能),所谓理性药物设计就更显得弱不禁风.
而默克跟进lambrolizumab的力度表明一旦概念验证实验显示靶点优势,大土豪会立即强取豪夺,以迅雷不及掩耳之势占领每一寸市场,令弱势群体望洋兴叹.
所以太早期项目成为分母的可能性太大,太晚的又无法和土豪竞争.
新药研发真正的窗口只存在于二期临床附近的短暂时段内,对这个时间区数据的准确解读至关重要.
从PD-1抑制剂MK-3475看新药研发的国际竞争2014年2月7日现在国际上竞争最激烈的新药研发项目当属PD-1和PD-L1抑制剂.
我们今天介绍一下国际大制药集团是如何快速、高效把机会变成利润的.
不管你对大集团的创新能力有何看法,我相信你了解了PD-1抑制剂的开发后会至少对这些公司大规模整合资源,快速占领每一寸市场的执行力叹为观止.
中国的制药企业要参与这个档次的竞争还有很长路要走.
默克现在如果要改名叫PD-1有限公司估计相当数量的股东会同意.
MK-3475,即lambrolizumab,是默克产品线里的白雪公主.
虽然施贵宝首先把PD-1抑制剂nivolumab推向临床,但默克很快嗅出了PD-1的潜力,迅速展开了一个1000人的一期临床,颠覆了传统的一期临床只是测药物耐受性的模式,而是直接盯着快速上市.
接着MK-3475申请并获得了FDA突破性药物地位,保证FDA不会成为瓶颈,为上市挪走一个关键限速步骤.
这一点很重要因为抗癌药物第二个上市在竞争中会处于很不利位置.
如果PD-1可行,lambrolizumab和nivolumab上市时间差别估计在半年之内,但不一定谁先谁后.
Nivolumab现在还没有突破性药物地位,但获得快速审批资格.
果然在一期临床黑色素瘤显示疗效之后,默克已经采用"滚动申报"(RollingSubmission),向美国FDA提交Lambrolizumab的"生物制品上市许可申请".
全部申报工作预计在今年上半年完成.
Lambrolizumab在黑色素瘤显示很好的单方疗效,但默克显然不会停留在单方/单适应症上,而是迅速与葛兰素,安进,辉瑞,和Incyte等四个公司签署了合作协议,分别与这些公司的其它抗癌药物联用寻求包括肺癌、肾癌、乳腺癌等多种恶性肿瘤的新疗法.
这些疾病目前的市场总额在已有的、相对疗效较差药物控制下已高达450亿美元.
如果Lambrolizumab能显著改善存活期,一来支付部门会同意支付更高药价,二来寿命更长的患者意味着更长用药时间,这两个因素可令Lambrolizumab成为年销售接近100亿美元的超级重磅药物.
当然这些合作并非没有代价,除了销售合作伙伴要分成之外,同时开发这么多适应症也需要大量的研发投入.
估计仅2014年,默克就会在Lambrolizumab投入近40亿美元的研发经费(给大家一个比较,40亿美元是2012年斐济全国一年的GDP).
从已有数据看Lambrolizumab至少治疗黑色素瘤应该上市没有问题,但现在毕竟还早.
新药历史给我们最重要的教训就是任何事情都可能发生,尤其是不利的事情.
这个案例可以给大家一个基本概念国际新药研发的竞争是咋个玩法.
当然这种单个品种一年研发投入40亿美元的壮举只有默克这种土豪才干的起,但如何有效花出去这些钱也不是件容易事.
除了胆识、经济实力你还得有完整的人才储备、基础设施、在合作伙伴中的信誉、和FDA良好的合作关系等.
参与这个级别的竞争的确是需要一定积累的.
热门药物靶点www.
yypharm.
cn6强生Imbruvica获FDA批准治疗慢性淋巴细胞白血病(CLL)2014年2月14日2014年2月12日,强生和Pharmacyclics公司的抗癌药Imbruvica(ibrutinib胶囊)获FDA批准,作为二线用药治疗之前接受过至少一次治疗但疗效不佳的慢性淋巴细胞白血病(CLL).
这是Imbruvica获得美国FDA批准的第二个适应症,之前已于2013年11月获得批准用于治疗既往至少接受过一次治疗但疗效不佳的套细胞淋巴瘤(MCL).
美国FDA均基于整体缓解率(ORR)批准Imbruvica的这两个适应症.
RBC资本市场的分析师MichaelYee认为Imbruvica最终能成为销售峰值高达50亿美元的重磅炸弹.
虽然Imbruvica的获批是意料之中的事,但当天Pharmacyclics股票还是上扬了6.
7%.
Imbruvica胶囊每粒含140毫克Ibrutinib,每日一次推荐剂量为560毫克(4粒).
Ibrutinib(PCT-32765)是PI3K通路的下游蛋白—布鲁顿(Bruton)酪氨酸激酶的不可逆抑制剂,能有效地阻止肿瘤从B细胞迁移到适应于肿瘤生长环境的淋巴组织.
据不完全统计,ibrutinib已经做过或者正在进行23个临床实验,评价其单独或联合用药,治疗慢性淋巴细胞白血病(CLL)、复发/难治性套细胞淋巴瘤(MCL)、弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤和多发性骨髓瘤等.
Imbruvica第一次向美国FDA同时申报MCL和CLL,但去年11月只有复发/难治性套细胞淋巴瘤适应症获批.
Imbruvica也是FDA推出"突破性药物"新政以来获准的第二个"突破性药物".
今年1月9日,Ibrutinib(依鲁替尼)的一个慢性淋巴细胞白血病(CLL)三期临床因超出预期实验终点提前终止.
按照去年12月强生/Pharmacyclics披露的临床结果,几乎所有首次采用Imbruvica治疗的患者和超过四分之三的复发CLL患者在一个27个月的中期随访中依然保持病情稳定.
慢性淋巴细胞白血病(ChronicLymphocyticLeukemia,CLL)是一种淋巴细胞血液癌症,在美国,CLL是一种罕见病.
据估计,每年有1.
6万人确诊为CLL,有近4600人不幸死于CLL.
Cangrelor被FDA专家组否决2014年2月14日【新闻事件】:昨天FDA专家组以7票反对,2票赞成拒绝Medicine'sCompany的注射抗凝药Cangrelor用于心脏搭桥手术.
所有专家反对Cangrelor作为急性心脏病患者手术前的抗凝药.
FDA将在今年4月做出最后决定.
【药源解析】:我们周一讲过Cangrelor,预计这个产品难以通过专家组的考核.
Cangrelor的前两个三期临床以失败告终,并被迫提前结束这两个临床实验.
这对一个临床药物来说是最灾难性的结果.
但Medicine'sCompany并没有气馁,而是做个第三个临床实验,并显示一定疗效.
当时看到他们在NEJM的文章还慨叹做药真得锲而不舍.
但实际上那个实验显然有一些设计缺陷.
Cangrelor是个很聪明的设计.
这个化合物口服不行,半衰期极短,应该是个残次品.
但Medicine'sCompany变废为宝,把它定位为手术用药.
因为半衰期短所以召之即来,挥之即去,适合对凝血不稳定的手术病人.
专家组成员,德州大学西南医学中心的Packer教授说他很想投赞成票,因为很喜欢这个药的设计理念.
但毕竟3期临床数据太勉强,而且有两个彻底失败的3期做背景,更令专家组对那个阳性临床也有所保留.
Cangrelor从诞生到现在可能已有15年左右,专利估计也没剩几年了.
所以Medicine'sCompany不大可能再做一个大型临床来换取一个小适应症.
加上阿斯列康的Brilinta也销售不佳,而且正在接受美国司法部的调查,快速可逆抑制P2Y12证明并没有比不可逆抑制剂波立维有什么过人之处.
原来立项假说是可逆抑制剂起效、失效都快,应该比波立维好很多,但15年、几十亿美元之后我们唯一得到是这个假说并没有临床意义.
这个代价似乎太大了点.
Gilead固定剂量的Ledipasvir/Sofosbuvir复方片剂在美申报上市,治疗基因1型的成人丙型肝炎2014年2月11日【新闻背景】吉利德科学公司(GileadScience)2月10日宣布,其每日一次、全口服、固定剂量的Ledipasvir/Sofosbuvir复方片剂已经向美国FDA申报上市(NDA),治疗基因1型的成人丙型肝炎.
该新一代的丙肝复方药每片含有90毫克的NS5A抑制剂ledipasvir(LDV)和400毫克的类核苷酸NS5B聚合酶抑制剂sofosbuvir(SOF),根据患者的治疗史或是否有肝硬化,每天配用一片连续8或12周,超过90%的基因1型丙肝患者治疗结束后达到了持久性病毒学应答(SVR).
持久性病毒学应答的定义是治疗结束24周后仍检测不到病毒基因.
如果该Ledipasvir/Sofosbuvir复方片剂获得FDA批准,将成为世界第一个治疗基因1型成人丙型肝炎的全口服,不含干扰素和利巴韦林的治疗方案.
【药源解析】由Pharmasset公司研发,后被吉利德收购的sofosbuvir是一种口服的NS5B聚合酶抑制剂.
Sofosbuvir是一个前药,在循环系统里释放靶向NS5B保守核苷酸结合袋的类核苷酸有效成分,并终止链聚合反应.
2013年12月6日,美国FDA批准了sofosbuvir(商品名:Sovaldi)上市,与利巴韦林联用治疗基因2、3型或与利巴韦林加上聚乙二醇干扰素(PEG-IFN),临床快讯www.
yypharm.
cn7治疗基因1、4、5、6型丙型肝炎病毒(HCV)感染.
虽然sofosbuvir是首款治疗基因2型丙肝感染的全口服药物,但还要和利巴韦林联合使用,而且治疗占病人比例更多的基因1型患者(在美国占75%),还需要和聚乙二醇干扰素联合使用.
吉利德科学这次向FDA申报的sofosbuvir和HCVNS5A聚合酶抑制剂ledipasvir的联合疗法不再需要配用利巴韦林或干扰素,根据患者的治疗史或是否有肝硬化,连续8或12周治疗,超过90%的基因1型丙肝患者疗程结束后达到了持久性病毒学应答(SVR).
吉利德科学公司做了三个Sofosbuvir和ledipasvir联合用药的三期临床,共招募超过两千位不同病史的丙肝患者.
ION–1实验注册有865位从未接受过治疗的丙肝患者,其中136例呈现肝硬化.
每日配给固定剂量400毫克的sofosbuvir和90毫克的ledipasvir,经过12周的治疗有97.
7%的病人治疗结束后达到了持久性病毒学应答(SVR12).
ION–2实验招募了440位有效患者,其中88位有肝硬化并接受其它方案治疗但效果欠佳.
治疗12周后有93.
6%的患者达到持久性病毒学应答,而24周后达到持久性病毒学应答的患者比例达到99.
1%.
ION–3实验针对没有接受过治疗也没有肝硬化的患者,采用上述组合治疗8周后,647例患者中的94%获得持久性病毒学应答.
疗程延长至12周时持久性病毒学应答的患者比例上升到95.
4%.
2013年美国FDA批准了27个新药,其中24个是NME,而sofosbuvir毫无置疑是最重要的一个.
以上吉利德推出的全口服sofosbuvir/ledipasvir固定剂量的复方组合是新一代有效、安全地治疗基因1型丙肝患者的新疗法,是丙肝治疗的一个划时代、革命性的突破.
因为不需要同时使用干扰素和利巴韦林,从而避免了多重包括感冒样症状的副作用.
相信该复方组合在不久的将来成为基因1型丙肝患者的金标准.
抗丙型肝炎的研究是近几年制药工业的研究热点之一.
目前,有近二十种的NS5B抑制剂处于不同阶段的临床实验中,与其它药物的各种复方组合的临床开发也如火如荼.
除了sofosbuvir/ledipasvir组合以外,走在最前面的还有Enanta/艾伯维的ABT450/ABT333/ABT267三联组合和默克的MK-5172/MK-8742组合.
这类全口服、无干扰素以及无利巴韦林的组合药物疗效更好,使用更方便,而且副作用远小于波西普韦或特拉普韦/干扰素/雷巴威林组合.
是瓜分250亿美元抗丙肝市场的有生力量.
尤其是Enanta/艾伯维的三联组合疗效和sofosbuvir/ledipasvir组合相仿,估计在2014年底或2015年初能在美上市,虽然sofosbuvir/ledipasvir走在前面,但后者届时也会争得一席之地.
注射抗凝药Cangrelor凶多吉少2014年2月11日【新闻事件】:本周三FDA专家组将讨论Medicines'sCompany的注射抗凝药,P2Y12可逆抑制剂Cangrelor的命运.
但今天FDA的内部评审出现两个声音.
ThomasMarciniak强烈反对Cangrelor上市,但另一FDA评审专家FredSenatore支持Cangrelor上市.
【药源解析】:P2Y12不可逆抑制剂波立维曾长时间高居畅销药前10名,并在利普陀专利到期后短暂成为销售额最大的药物,但很快它自己专利也到期,销量一个季度暴跌90%多.
波立维作为不可逆抑制剂起效慢,如果发生出血去活也慢,所以寻找可逆抑制剂成为一个诱人的项目.
Cangrelor最早由英国一小公司开发,后被阿斯列康收购.
阿斯列康保留了口服P2Y12可逆抑制剂Brilinta,而把注射版Cangrelor转让给Medicine'sCompany.
Brilinta据说花了24亿欧元开发,但上市以来由于和波立维区分有限销售一直不好,尤其在美国市场吸收极其缓慢.
上市3年后2013年全球销售仅不到三亿美元,和开发成本极不相符.
Cangrelor是Brilinta开发过程中的一个早期中间药物,因为含三磷酸(该系列药物是从三磷酸腺苷作为先导物优化而来,从药化角度讲是个非常了不起的成就)所以无法口服.
另外因为这个三磷酸Cangrelor半衰期也很短,好像只有几分钟.
Medicine'sCompany决定把Cangrelor作为手术用药,在手术室注射并不是太大障碍,反而有些重症病人口服倒是问题.
Cangrelor的超短半衰期也可以成为一个优势因为手术后一停药药效很快消失.
Cangrelor作为心脏搭桥手术时的抗凝药开发,但在前两个大型三期临床实验中未能显示比波立维更优越.
Medicine'sCompany并没有放弃(可能经济上也无法放弃),做了一个叫PHOENIX的第三个三期临床结果显示比波立维更好.
但Marciniak认为波立维组用药时间太晚,剂量不足,只在稳定心绞痛患者有更好疗效而这类病人可以很容易用波立维控制.
除了疗效不明显,Cangrelor显示可能对某些病人有严重副作用.
另外Marciniak认为其中一个叫CHMPION的实验违反医学伦理,仅这一点就应该拒绝Cangrelor的上市申请.
Cangrelor的命运很快就会清楚,但FDA内部的负面意见,至少看上去是有确凿证据支持,是Cangrelor头顶上的一块乌云.
今天投资者的反应也很消极,Medicine'sCompany股票一度下跌13%.
我们估计Cangrelor凶多吉少.
临床快讯www.
yypharm.
cn8双药记:dacomitinib和afatinib2014年1月29日【新闻事件】:昨天辉瑞宣布其非小细胞肺癌药物dacomitinib在两个三期临床中失败.
Dacomitinib是不可逆、非选择HER抑制剂(即同时抑制HER1,又称EGFR,HER2,HER3,HER4).
在一个叫做ARCHER1009的实验中,dacomitinib作为2、3线用药没有显示比单靶点EGFR(即HER1)抑制剂特罗凯更有效延长无进展生存期.
在另一个叫BR26的实验中,dacomitinib作为末线药物(病人对所有已知疗法无应答,已经没有其它选择)和安慰剂比没有延长总生存期.
Dacomitinib本来就是较小产品,如果上市估计峰值销售在3-5亿美元.
【药源解析】:说起dacomitinib不能不提到它的兄弟,BI的同类药物afatinib.
任何药物化学家看到这两个药物的化学结构都会预测二者会有十分类似的疗效和安全性,事实上也可能的确如此.
那为什么afatinib去年7月作为EGFR变异非小细胞肺癌的一线药物上市而dacomitinib却几乎不会上市呢非小细胞肺癌是非常复杂的一类(而不是一个)疾病,其中15-20%有EGFR变异.
Afatinib针对就是这个较小但相对均匀并最有可能有应答的人群.
这种断臂求生的手段虽然会限制药物的使用人数,但大大增加药物显示疗效的可能,因为EGFR抑制剂自然对EGFR过度猖狂的肿瘤更可能有效.
反观dacomitinib,其临床实验只要求病人是非小细胞肺癌,对EGFR水平没有要求.
另外dacomitinib的这两个实验针对的是更加难以治疗的末期病人,所以和已有药物甚至安慰剂的区别更难做到.
残酷的现实是即使在今天,很多疾病仍然远远超出医学技术的能力范围.
在ARCHER1009中,多靶点药物dacomitinib并没有显示和单靶点药物特罗凯有疗效上的区分.
一种可能是这些病人可能已经非常晚期,无法通过药物挽救.
还有一种可能即多靶点并不意味着高疗效.
这一点也被很多复方并不比单方更有效的事实所佐证.
现在的科技水平还远远做不到从生物学原理开始设计有效的药物.
任何在临床发现真正有效的药物应该作为上帝的礼物而不是技术的成功而庆祝.
最后,dacomitinib还有一个叫做ARCHER1050的实验正在进行中.
这个实验比较dacomitinib和EGFR抑制剂易瑞沙作为有EGFR变异非小细胞肺癌的一线药物.
根据afatinib的经验,dacomitinib很可能比易瑞沙更能延长无进展生存期(实验的一级终点),但无法延长总生存期(二级终点).
但在目前的支付环境下dacomitinib将很难蚕食afatinib的市场.
虽然辉瑞并没有宣布停止ARCHER1050,但这个实验已经没有什么商业价值.
一人得道,鸡犬依旧:PI3K通路抑制剂的艰难历程兼谈理性药物研发的窘境2014年2月6日PI3K-AKT-mTOR通路过度活跃是肿瘤的一个常见特征,这个信号通路控制很多肿瘤的标志性特性以及肿瘤微环境的维护.
这个通路是人类肿瘤中最为常见的变异信号途径,其二级信使PIP3在多数肿瘤细胞过度活跃.
而且这条通路与另一条和肿瘤密切相关的信号通路RAS-RAF-MEK通路关系暧昧,类似狼和狈的关系,所以过去10年抑制PI3K通路是抗癌药研发的一个重要战地.
雷帕霉素类似物的上市、尤其是最近选择性p110-(PI3K的一个亚型)抑制剂Idelalisib和PI3K下游蛋白BTK抑制剂Ibrutinib的巨大成功,似乎把PI3K变成一个理性药物设计的成功案例.
但事实上情况远比这复杂,今天《NatureReviewDrugDiscovery》有一篇文章详细介绍了这个领域的开发工作.
首先,雷帕霉素类似物的单方疗效一般,需要与其他药物联合使用.
当然这也是很大的技术进步,但和其它家族肿瘤驱动基因如BRAF、ALK、BCR-ABL抑制剂比较,PI3K通路抑制剂的单方疗效普遍很弱,虽然有几个雷帕霉素类似物上市,但大量的PI3K相关抑制剂还在临床摸索中.
主要的问题是如何选择适用病人和科学、经济地找到可以其它抗癌药复方连用的机会.
一个关键的问题是PI3K在正常细胞功能很重要,而在肿瘤细胞、尤其晚期肿瘤细胞中的作用比原来想象的小.
这导致临床药物剂量无法太大因为会损伤正常细胞.
加上早期的抑制剂选择性差,抑制所有PI3K亚型,更限制了可以耐受剂量.
另外由于PI3K通路的重要性,机体为防止这条通路出现故障的灾难后果准备了一些替代通路和反馈机制.
所以抑制这条通路经常会导致PI3K活性的代偿性增加以及启动备用通路,致使治疗失败.
那为什么Idelalisib效果这么好呢这纯粹是个意外.
Idelalisib本身并不能杀死癌细胞,其疗效来自其改变肿瘤的免疫环境.
在PI3K的诸多亚型和这条通路上的大量其它可能靶点中,Idelalisib的靶点p110-是最不可能有抗癌作用的.
P110-在肿瘤细胞中表达正常,也无激活变异(BTK也一样),并且对正常B细胞的生存至关重要.
这几点基本上可以保证任何有点新药开发知识的人都不会把p110-作为一个抗癌靶点.
P110-就是分子版的灰姑娘,一个站在一大群大家闺秀中的女仆.
然而虽然运气不能作为研发项目的核心,但遗憾的是对于很多疾病运气依然是我们最有力的武器.
P110-主要在免疫细胞表达,所以Idelalisib作为免疫疾病药物上了临床,但发现对同时患有B细胞癌的少数患者有神奇的抗癌作用.
这个重要的临床观测导致了后来Idelalisib的成功.
另一个小插曲是有关PI3K通路的一个重要成员AKT,很多公司也曾追逐过这个靶点.
但多数AKT抑制剂无法区分AKT1和临床快讯www.
yypharm.
cn9AKT2.
AKT1和癌症相关,但抑制AKT2可以诱发糖尿病.
所以有人用糖尿病药物二甲双胍和AKT抑制剂联用来控制糖尿病副作用,但现在越来越多证据表明二甲双胍可以通过激活AMPK而降低mTOR信号而直接抗癌.
这就是我们现在理性药物设计的现状.
所以整个PI3K领域如果没有Idelalisib这个意外发现基本是和其它一度热门的靶点一样是个失败的选择.
虽然现在还有很多工作正在进行,但Idelalisib的一人得道,对这条通路上的鸡犬来说并无太大帮助.
Idelalisib也凸显理性药物设计还在婴儿期,如果有人根据临床前和生物数据提出用Idelalisib抗癌所有人都会认为这人喝多了.
无独有偶,历史上最成功的药物,也是理性药物设计的经典,他汀虽然抑制胆固醇合成却没有减少胆固醇在动脉血管的蓄积,而是能降低这些蓄积物的崩解风险,从而降低心血管疾病.
比尔盖茨常说"youdidn'tgetthefirstthingaboutthis".
我只能说老大您过奖了,wedidnotgetanythingaboutthis.
对于还有机会重新做人的制药界朋友,如果我讲了这么多你还不想改行干点别的,我实在是帮不了你了.
Palbociclib的二期临床PALOMA-1实验完成,辉瑞公布其积极结果2014年2月4日【新闻背景】2014年2月3日,辉瑞公布了其CDK4/6抑制剂palbociclib和来曲唑(letrozole)联合用药的一个二期临床——PALOMA-1实验的最终结果.
该随机、国际多中心的二期临床实验注册了450名雌激素受体(ER)阳性、人类表皮生长因子受体-2(HER2)阴性,绝经后妇女的乳腺癌患者.
这些病人被随机分为palbociclib/来曲唑联合用药组,每四周当中的连续三周每天一次配给125毫克palbociclib和连续每天2.
5毫克的来曲唑,来曲唑单独用药组仅连续配给2.
5毫克的来曲唑.
实验发现,palbociclib联合用药组和来曲唑单独用药组相比,无论是对局部晚期或新诊断的转移性乳腺癌患者,无进展生存期都显著延长,并具有统计学显著.
达到实验的一级实验终点.
详细实验结果将在今年4月5日,在圣地亚哥举行的美国癌症协会年会(AACR)上报道.
【药源解析】以上实验结果是去年4月ASCO年会上报道的PALOMA-1实验阶段性结果的继续.
早期结果显示,palbociclib和来曲唑联合用药和后者的单独用药相比,用于治疗ER阳性、HER2阴性,局部晚期或转移性乳腺癌患者,中位无进展生存期从单独用药的7.
5个月延长至26.
1个月,具有统计学显著.
根据这个阶段性结果,2013年4月美国FDA授予palbociclib"突破性药物"称号.
日前辉瑞的报道进一步证实了palbociclib作为一线用药的积极疗效.
Palbociclib是辉瑞的最重要晚期临床开发之一.
2013年2月,辉瑞开展了一个多中心、双盲的三期临床——PALOMA-2实验,预计注册450名ER阳性、HER2阴性,局部晚期或转移性乳腺癌患者,进一步验证Palbociclib和来曲唑(letrozole)联合用药的疗效和安全性.
无进展生存期是该实验的一级终点.
二级实验终点包括总存活期、存活率以及应答率等.
整个实验预计至2016年完成.
2013年9月,辉瑞还开始Palbociclib的又一个三期临床——PALOMA-3实验,评价Palbociclib和氟维司群(fulvestrant)联合用药相比后者单独用药的疗效和安全性.
这个三期临床预计注册417位ER阳性、HER2阴性,采用内分泌疗法治疗但依然有进展的晚期或转移性乳腺癌患者.
这个实验预计到2017年完成.
无容置疑,辉瑞为了Palbociclib的尽早上市作出许多努力,根据clinicaltrials.
gov记录,辉瑞前后进行了超过24个临床实验,评价Palbociclib单独或联合用药,治疗固体肿瘤(例如乳腺癌、肺癌)和血液肿瘤的疗效和安全性.
辉瑞还充分利用了palbociclib获得FDA"突破性药物资格"的优势,得以和FDA专家积极沟通.
但是还没有迹象表明,FDA支持palbociclib在获得三期临床结果之前申报NDA.
即使如此,palbociclib依然领先CDK4/6抑制剂的研发领域.
最接近的竞争对手包括诺华的LEE011,于2013年12月份进入三期临床研究.
诺华公司负责癌症药物研发的WilliamSellers表示LEE011的二期临床结果令人满意,足以与辉瑞公司的palbociclib相媲美.
临床快讯www.
yypharm.
cn10强生宣布通过耶鲁大学公布临床数据2014年1月31日【新闻事件】:今天美国制药公司强生宣布将通过耶鲁大学公布其产品的临床数据,公众可索取药品甚至大众消费品如漱口水的临床数据.
耶鲁而不是强生将决定如何公开这些数据.
这是继GSK之后第二个大制药集团宣布公开临床数据,也是制药工业走向公开透明的另一里程碑.
福布斯分析家称这个决定是开放科学的一个难以置信的胜利(stunningwin).
【药源解析】:临床数据以前被认为是公司的私有财产,因为是制药公司花巨额资金收集了这些数据.
但这导致有些公司隐瞒不利数据或有选择地发表有利于产品销售的数据.
比如一个产品做了10个临床实验,有5个显示有效5个显示无效(这在中枢神经系统疾病很常见).
如果全部10个实验都发表医生可能会认为这个药疗效一般,但如果只发表那5个疗效好的实验则给医生造成这个药物十分有效的错觉.
这引起很多专家和消费者保护组织的强烈抗议.
现在所有临床实验必须在clinicaltrials.
gov注册,实验完成3年之内必须公开发表.
虽然仍然有很多实验结果没有严格执行这些规定,但制药工业越来越公开透明是不可逆转的大趋势.
公开临床实验结果是对参加实验的志愿者和病人的基本尊重,也是对人类知识的重要贡献,同时可以避免不必要重复无效或有害的人体实验,所以有很多积极意义.
但和任何事情一样,有积极的一面也必然有消极的一面.
临床数据公开不等于老百姓可以自己根据这些数据做治疗决定,也不一定总是好事.
医学数据十分复杂,不是所有人都能准确科学地分析临床实验数据.
这些数据的公开可能产生严重的意想不到的后果.
一种可能是一些纯外行有机会来"分析"这些邪恶药厂隐藏多年的数据,然后一些阴谋论者会不负责任地传播这些错误的结论.
拿我们报道多次的糖尿病药物Foxiga来说,临床实验中用药组有9人而对照组只有1人得了膀胱癌.
有人可以说Forxiga增加9倍癌症风险.
你要跟他说这没有达到统计显著可能是随机事件他会说明明9:1在那摆着还狡辩,你们这些做药的没一个好人.
另外有些阴谋论者非常愿意传播错误信息,似乎任何和药厂对立的行为都是替天行道.
1998年AndrewWakefield造假发表一篇文章称MMR疫苗导致自闭症,结果很多媒体和名人似乎找到了制药工业的一个见不得人的秘密,大肆宣传这个错误结论,很多家长拒绝为孩子疫苗注射,导致后来多起MMR爆发事件.
该文于2011年被撤回.
另一种可能是有些人想扬名立腕.
如果你分析这些公开数据和原来药厂的结论一致显然无法证明你是个腕,也基本没有可能发表.
这给这些人很大的动力推翻原文结论,也提供了潜在的不公正解读数据的可能.
还有一种可能就是分析实验的偶然发现,而不是预先设定的实验终点.
这成了一种统计钓鱼游戏,只能得出十分不可靠的结论.
所以公开临床数据并非有百益而无一弊.
如何找到平衡点还需要制药工业和整个学术界的共同努力.
诺华充分利用突破性药物资格给予的优惠,采用中期临床结果申报ALK抑制剂LDK378上市2014年2月2日【新闻背景】据FierceBiotech周四报道,诺华准备充分利用其ALK抑制剂LDK378获得美国FDA突破性药物资格带来的优惠,在获得三期临床结果之前,直接采用中期临床的数据申报上市申请(NDA).
在一个含有88例ALK阳性,使用克里唑蒂尼治疗仍然有进展患者参加的一期临床实验中,有高达百分之八十的患者对LDK378表现应答.
自FDA在2012年开始推行"突破性药物"评审以来,一共有37个药物获得"突破性药物资格",其中Gazyva、Imruvica和Sovalldi三个药物已经获得FDA批准上市,但是这些药物都是通过积极的三期临床结果才获得FDA批准.
【药源解析】在最短时间内获得监管部门在最大范围内的上市批文是成功开发一个新药的关键.
这除了"打铁要靠自身硬"以外,得到监管部门最大的支持和即时的沟通必不可少.
无可否认,FDA各个领域的专家小组都是本领域的顶级专家,在很大程度上能给开发药厂提出极为合理的临床方案.
所以,一个药厂在临床实验开始之前,和在临床实验取得阶段性结果以后都应该征求这些专家的意见,甚至在必要的时候临时修改方案,以保证整个实验结束后不会因为设计失误,未能取得FDA的认可.
当然,专家也可能百密一疏,如果药厂相信临床方案比专家小组想得更周到,这时更应该即时和专家小组沟通,以便获得他们的承认.
和监管部门之间的沟通无论对那个药厂都是重中之重.
默克研发总监RogerPerlmutter认为默克的安眠药suvorexant和麻醉解药sugammadex未能在美国上市就是因为和FDA的沟通不够.
尤其是Sugammadex作为一个突破性的麻醉药物已经饱受专业人士的赞扬,而且在除了美国以外的大部分国家已经上市销售.
但遗憾的是,Sugammadex的临床设计并没有完全回复FDA关于超敏反应的疑问,而且临床剂量也太高.
如果及时和专家小组沟通,并完全按照建议修改方案,或许这两个药的命运会完全不同.
相反,尽管其抗血小板药物vorapaxar的两个三期临床都因增加的流血事件而陷入困境,但是通过分析患者亚群发现,出血事件大多发生在有中风病史的人,从而在得到FDA专家组支持的情况下及时更改了临床方案,而且得到积极的结果.
2014年1月16日,FDA专家组以10票支持1票反对支持Vorapaxar上市,用于预防已有心梗病史患者的心血管疾病.
NameCheap域名转入优惠再次来袭 搜罗今年到期域名续费
在上个月的时候也有记录到 NameCheap 域名注册商有发布域名转入促销活动的,那时候我也有帮助自己和公司的客户通过域名转入到NC服务商这样可以实现省钱续费的目的。上个月续费转入的时候是选择9月和10月份到期的域名,这不还有几个域名年底到期的,正好看到NameCheap商家再次发布转入优惠,所以打算把剩下的还有几个看看一并转入进来。活动截止到9月20日,如果我们需要转入域名的话可以准备起来。 N...
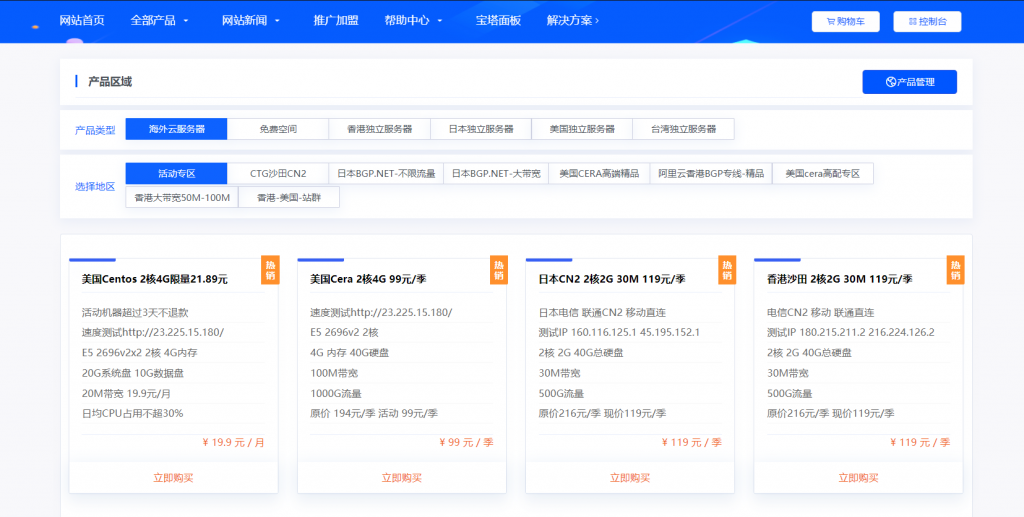
妮妮云(119元/季)日本CN2 2核2G 30M 119元/季
妮妮云的知名度应该也不用多介绍了,妮妮云旗下的云产品提供商,相比起他家其他的产品,云产品还是非常良心的,经常出了一些优惠活动,前段时间的八折活动推出了很多优质产品,近期商家秒杀活动又上线了,秒杀产品比较全面,除了ECS和轻量云,还有一些免费空间、增值代购、云数据库等,如果你是刚入行安稳做站的朋友,可以先入手一个119/元季付的ECS来起步,非常稳定。官网地址:www.niniyun.com活动专区...
小白云 (80元/月),四川德阳 4核2G,山东枣庄 4核2G,美国VPS20元/月起三网CN2
小白云是一家国人自营的企业IDC,主营国内外VPS,致力于让每一个用户都能轻松、快速、经济地享受高端的服务,成立于2019年,拥有国内大带宽高防御的特点,专注于DDoS/CC等攻击的防护;海外线路精选纯CN2线路,以确保用户体验的首选线路,商家线上多名客服一对一解决处理用户的问题,提供7*24无人全自动化服务。商家承诺绝不超开,以用户体验为中心为用提供服务,一直坚持主打以产品质量用户体验性以及高效...

-
2017年双11销售额2018年双十一(11.11)淘宝天猫一天的交易额能突破2500亿吗?华为p40和mate30哪个好mate30 5G和p40 5G有什么区别?绝地求生加速器哪个好绝地求生哪个加速器好用一点,求推荐一个英语词典哪个好哪个英语词典好游戏盒子哪个好游戏盒子哪个好?核芯显卡与独立显卡哪个好核芯显卡和独立显卡有什么区别?最好的是哪个?雅思和托福哪个好考托福、雅思哪个好考?视频软件哪个好安卓系统在线看视频软件哪个好群空间登录怎样进入群空间qq空间登录不上为什么我的QQ空间登陆不上?