分枝淘宝摇一摇怎么进入
淘宝摇一摇怎么进入 时间:2021-01-27 阅读:()
ResearchPaper研究报告微生物学报ActaMicrobiologicaSinica52(12):1467-1476;4December2012ISSN0001-6209;CN11-1995/Qhttp://journals.
im.
ac.
cn/actamicrocn基金项目:国家"863计划"(2012AA101602);国家自然科学基金(30800014);浙江农林大学人才项目(2034020075)*通信作者.
Tel:+86-571-63741392;E-mail:songhh@zafu.
edu.
cn作者简介:#共同第一作者.
蔡潇浪(1991-),男,浙江瑞安人,学士,主要从事病原微生物遗传学研究.
吴蓓蓓(1979-),女,浙江苍南人,博士,副研究员,主要从事结核分枝杆菌病原学研究.
收稿日期:2012-06-05;修回日期:2012-07-05天冬酰胺酶介导的分枝杆菌酸适应机制蔡潇浪1#,吴蓓蓓2#,方扬1,宋厚辉1*1浙江农林大学动物科技学院,临安3113002浙江省疾病预防控制中心,杭州310051摘要:【目的】结核分枝杆菌可以在宿主细胞内的酸性环境中长期存活.
为了探明天冬酰胺酶(AnsA)代谢通道介导的分枝杆菌在酸性环境中的适应机制,分别通过体内和体外实验,对AnsA的活性、突变体性质进行了分析.
【方法】以无致病性的卡介苗分枝杆菌(M.
bovisBCG)为模式菌,扩增天冬酰胺酶编码基因ansA并在大肠杆菌中进行表达和纯化,对AnsA的酶学活性进行了分析.
在卡介苗分枝杆菌中将ansA敲除,对其抗酸、产氨等特性进行了研究.
【结果】纯化的重组AnsA在体外可以将天冬酰胺分解并产生氨.
在酸性培养基中,分枝杆菌利用天冬酰胺产生的氨,可以释放到培养基中,将酸性培养基中和.
敲除ansA后,卡介苗分枝杆菌在酸性环境中的生长滞后10天左右.
为了更好的理解天冬酰胺介导的抗酸机制,绘制了天冬酰胺代谢、氨产生和转运示意图.
【结论】结核分枝杆菌的抗酸特性之一是通过分泌氨将周围的酸性环境中和来实现的.
氨来源于分枝杆菌AnsA对底物天冬酰胺的分解.
这为揭示结核分枝杆菌在宿主巨噬细胞内酸性环境中的生存机制提供了线索.
关键词:卡介苗分枝杆菌,天冬酰胺,天冬酰胺酶,酸适应性中图分类号:Q935文献标识码:A文章编号:0001-6209(2012)12-1467-10结核分枝杆菌(Mycobacteriumtuberculosis,Mtb)是引起肺结核(Tuberculosis,TB)的致病菌,目前全球大约有1/3人口为结核阳性.
根据WHO最新报告,2010年全球大约有145万人口死于TB[1],其中我国人口结核的感染率居世界第二.
结核分枝杆菌在宿主体内主要感染巨噬细胞,属于胞内寄生菌且能在宿主细胞酸性溶酶体和吞噬小体内的微环境(pH5.
5左右或者更低)中长期存活[2],因此对其抗酸机制的了解是阐明其致病和耐药机制的前提.
但是,不同的细菌在进化中形成的抗酸机制不同.
比如:胞外菌幽门螺杆菌(Helicobacterpylori)和副溶血弧菌(Vibrioparahaemolyticus)进入宿主体内之后,可以通过自身的尿素酶将尿素分解并将产生的氨释放到细菌细胞外,迅速中和消化道内的酸性环境来实现其抗酸生长,同时利用氨破坏上皮细胞[3-4].
而胞内寄生菌单核细胞增多性李斯特菌(Listeriamonocytogenes)则通过精氨酸脱亚氨酶对精氨酸的脱氨基作用适应宿主酸性环境[5].
慢性生长的结核分枝杆菌与其它快速生长的胞内和胞外菌又有所不同,因为结核分枝杆菌需要在酸性环境中存活数月或者数年,在特定的宿主巨噬细胞内即需要抵抗来自宿主细胞的各XiaolangCaietal.
/ActaMicrobiologicaSinica(2012)52(12)种杀伤因子(如:超氧离子、细胞因子等)[6],还需要从环境中获取营养维持自身生存,更需要耐受来自溶酶体或吞噬溶酶体的酸应激.
那么,结核分枝杆菌是如何适应周围的酸性环境呢我们在前期的研究工作中发现:结核分枝杆菌能够利用天冬酰胺产生氨,且通过外膜蛋白OmpATb输送到细菌细胞外[7].
为了进一步阐明"氨"和分枝杆菌的抗酸机制,在本研究中,我们利用无致病性的卡介苗分枝杆菌为模式菌,通过模拟酸性环境和氮源,我们发现卡介苗分枝杆菌产生的氨来自天冬酰胺酶对天冬酰胺的降解作用,这是目前揭示分枝杆菌抗酸机制的最新发现.
1材料和方法1.
1材料1.
1.
1化学试剂、菌株和质粒:本实验室所用的化学试剂均为分析纯,购自Sigma、USP和BD等公司.
卡介苗分枝杆菌(M.
bovisBCG)由本实验室的合作实验室(阿拉巴马大学Niederweis实验室)提供.
大肠杆菌克隆用菌株为DH5a.
质粒pHL002(ansA表达载体)、pHL084(ansA基因敲除载体)由本实验室构建并保存.
其中pHL002是pET28(b)的衍生质粒,pHL084是pML564的衍生质粒[7].
质粒图谱分别如图1和图2所示.
1.
1.
2细菌培养:大肠杆菌培养基为LB培养基,37℃培养.
卡介苗分枝杆菌培养基为7H9/OADC培养基(液体)和7H10/OADC培养基(固体),37℃培养.
筛选用抗生素浓度:Hygromycin(潮霉素,50-200μg/mL).
1.
2卡介苗分枝杆菌ansA原核表达载体和基因敲除载体的构建1.
2.
1ansA原核表达载体:本研究所用的引物名称和序列如表1所示.
采用ansAfwd/ansAHisRev引物从卡介苗分枝杆菌基因组中扩增ansA基因,利用NcoI/HindI酶切位点连入pET28(b)中,命名为pHL002.
卡介苗分枝杆菌与结核分枝杆菌(H37Rv)的ansA同源性100%.
1.
2.
2ansA基因敲除载体的构建:采用ansAusfwd/ansAusrev引物从卡介苗分枝杆菌基因组中扩增ansA上游同源臂(1069bp),利用SpeI/SwaI酶切位点连入pML523中,命名为pHL083.
然后采用ansAdsfwd/ansAdsrev引物从卡介苗分枝杆菌基因组中扩增ansA下游同源臂(1014bp),利用PacI/NsiI酶切位点连入pHL083中,命名为pHL084.
所有插入片段均经过测序验证序列的正确性.
表1引物名称和序列Table1PrimersusedinthisstudyPrimerSequence(5'→3')ansAfwdAACCATGGGAGCAAACCACGTGCGCansAHisRevGCAAGCTTCAGTGGTGGTGGTGGTGGTGGCCCCAACGGTCGATGACGTCGansAusfwdTGGACTAGTACGTCGAGACGTTCTGCGAACGGTTansAusrevCGCATTTAAATAACTCACCGGTCGCCGACGTCATCGAansAdsfwdTGGTTAATTAATGTCCCTCCAGTAGTGATGACGGTGAansAdsrevTGTATGCATAACGATGTCGTCGTCGGAATACAGAAT1.
3ansA基因敲除和筛选步骤将pHL084质粒(该质粒为温度敏感型质粒,当温度高于39℃时停止复制)转化入卡介苗分枝杆菌感受态细胞中,在7H10/OADC/Hyg平板上筛选,用锡箔纸密封后于35℃培养.
3-4周后,挑选平板上任一单菌落,在7H9/OADC/Hyg液体培养基中摇菌,待OD600达到1.
0左右时候然后稀释成浓度1∶10-1-10-6,涂布7H10/OADC/Hyg平板,用锡箔纸密封后于39℃培养.
3-4周后,挑选平板上单菌落进行菌落PCR和Southern杂交验证,此时在基因组水平上发生同源重组:单交换(Singlecrossover,SCO).
然后将任一单交换克隆,在7H9/OADC/Hyg液体培养基中摇菌,至OD600达到1.
0时,按照1∶10-1-10-6稀释,涂布7H10/OADC/Hyg/2%Sucrose平板,用锡箔纸密封后于39℃培养.
3-4周后,利用荧光(鉴定方法见1.
8)和Southern杂交验证,此时在基因组水平上发生双交换(Doublecrossover,DCO).
在双交换菌株中,ansA被hyg-gfp替代.
其中,hyg为潮霉素抗性基因,gfp为绿色荧光蛋白基因.
我们这样构建突变株的目的是为了得到ansA基因缺失株的同时,也得到能够表达绿色荧光蛋白的标记株,优点是可以在后续的细胞实验中,追踪细菌在巨噬细胞中的定位.
采用这种策略构建基因缺失株的前提是ansA和及其上下游的基因不能属于同一个操纵子.
这一点,我们已经通过网络服务器对ansA及其上下游基因进行了操纵子预测(http://www.
microbesonline.
org/about_operon.
8641蔡潇浪等:天冬酰胺酶介导的分枝杆菌酸适应机制.
/微生物学报(2012)52(12)html),证实了ansA及其上下游基因不属于操纵子,因此本实验采用的构建策略不存在潜在的极性效应.
1.
4卡介苗分枝杆菌感受态细胞的制备卡介苗分支杆菌感受态的制备方法采用本实验室报道的方法进行[8].
即:将分枝杆菌在100mL7H9/OADC液体培养基中培养至OD600为0.
5,离心收获菌体,用10%预冷的甘油将菌体洗涤3次,最后用1mL10%甘油悬浮菌体(感受态细胞).
电穿孔转换参数为:1000Ω,2.
5kV,25μF.
电击杯宽度为4mm.
1.
5天冬酰胺酶的表达和纯化天冬酰胺酶在大肠杆菌中的表达和纯化参照本实验室报道的方法进行[7].
即:将pHL002转化入大肠杆菌Rosetta感受态细胞中,用0.
1mmol/LIPTG诱导过夜(16℃).
采用超声波方法破碎细胞,利用Co2+树脂(BD公司)纯化AnsAHis.
1.
6天冬酰胺酶活性分析在100μLPBS(pH7.
2)缓冲液中,加入2.
5mmol/L天冬酰胺为底物和3μg纯化的天冬酰胺酶.
如果天冬酰胺酶具有活性,将分解天冬酰胺产生氨.
产生的氨在溶液中以NH4+离子形式存在,利用德国拜发公司的氨检测试剂盒检测溶液中氨的浓度,操作步骤按照试剂盒说明书进行.
该方法的原理是氨可以和试剂盒提供的2-氧戊二酸盐(2-oxoglutarate)反应生成谷氨酸盐,同时将NADH氧化成NAD,其中NADH对340nm的吸收度与氨的浓度成线性关系,因此可以定量检测反应液或者培养基中氨的浓度.
1.
7Southern杂交利用Southern杂交鉴定基因缺失株采用文献报道的方法进行[9].
其中探针为ansA上游同源臂,标记采用地高辛方法(Roche公司),探针标记和检测参照试剂盒提供的说明书进行.
卡介苗分枝杆菌基因组利用NruI酶切后采用真空转印法到杂交膜上,显色采用NBT/BCIP.
1.
8报告基因检测ansA基因敲除载体pHL084含有两个报告基因,分别为xylE和gfp.
其中xylE为儿茶酚双加氧酶基因,表达产物可以将无色的邻苯二酚(Catechol)氧化成黄褐色的醌类物质,菌落在平板上表现为黄褐色.
gfp为绿色荧光蛋白编码基因,菌落在平板上表现为绿色荧光.
ansA基因单交换株在邻苯二酚存在的条件下表现为肉眼可见的黄褐色,荧光显微镜下为绿色荧光.
双交换株在邻苯二酚存在的条件下不发生任何颜色变化,但为绿色荧光.
通过菌落在平板上的颜色转换可以快速区分单交换和双交换,加速基因缺失株的筛选过程.
筛选用的邻苯二酚浓度为100mmol/L,用50mmol/L的磷酸钾缓冲液(pH7.
2)配制,于4℃避光保存,使用时直接滴在菌落或者喷洒在菌落上面.
GFP荧光菌落利用Olympus荧光体视显微镜(SZX-16)进行观察和照片拍摄.
1.
9卡介苗在酸性培养基中的氮源利用实验利用HdB[10]培养基为基础培养基,碳源为甘油,氮源为15mmol/L天冬酰胺,pH为5.
5.
卡介苗种子液先在7H9/OADC/Tween80培养基中培养至OD600约为2-3.
然后离心收集菌体,并用灭菌水(含0.
1%Tween80)洗涤3次,去除原始培养基中的营养成分,转接于250mL上述HdB培养基中,起始OD600为0.
01,连续培养4周,每天取1mL检测OD600、pH和氨的浓度.
其中pH和氨的浓度检测需要将菌液用0.
2μm滤器过滤后取无菌滤液进行.
pH检测采用酸度计(VWR),氨的浓度检测采用酶动力学方法(见1.
6).
2结果2.
1天冬酰胺酶在大肠杆菌中的表达、纯化和活性分析为了检测天冬酰胺酶的活性,首先我们构建了分枝杆菌天冬酰胺酶原核表达载体为pHL002(图1-A),并在大肠杆菌中对卡介苗分枝杆菌天冬酰胺酶进行了表达,并用Co2+树脂对表达产物进行了纯化.
结果表明:分枝杆菌天冬酰胺酶在大肠杆菌中以可溶性形式进行表达,不形成包涵体(图1-B).
从超声波裂解物的上清液中纯化的rAnsAHis在SDS-PAGE胶上为单一条带,大小与预期完全一致,且能把天冬酰胺分解产生氨(图1-C),这说明纯化的天冬酰胺酶具有生物学活性.
此外,由于在本实验进行期间,缺乏天冬酰胺酶抗体进行Western验证,我们直接将图1C中纯化的34kDa的蛋白条带从胶上切割下来,胰酶处理后,送往中科院上海生化细胞所蛋白质组研究分析中心进行质谱分析,结果表明纯9641XiaolangCaietal.
/ActaMicrobiologicaSinica(2012)52(12)化的rAnsAHis可以被胰酶切割成11个肽段,肽段序列可以完全映射到AnsA的参考蛋白序列上(图1-D),说明大肠杆菌表达的重组天冬酰胺酶完全正确.
图1天冬酰胺酶在大肠杆菌中的表达、纯化和活性分析Fig.
1Expression,purificationandenzymaticcharacterizationofAnsA.
A:TheansAgenefromM.
bovisBCGwasclonedintopET28(b)vectorunderT7promoterviaNcoI/HindIII.
B:SDS-PAGEseparationofthepurifiedrAnsAHis.
C:EnzymaticactivityofthepurifiedAnsA(Asparaginase)inthepresenceofasparagine.
Ammoniaconcentrationinthesesampleswasdeterminedusinganenzymaticmethodbasedonthesynthesisofglutamatefrom2-oxoglutarateandammoniabyglutamatedehydrogenase.
D:TypsintreatedrAnsAHis(fromFig.
1B)wasanalyzedbyLCQ/LTQmassspectrometer.
Peptidefragments(P1-P11)weremappedtoAnsAreferenceproteinbyBuildSummarysoftware.
图2卡介苗分枝杆菌突变株菌落的荧光鉴定Fig.
2PlasmidconstructionandM.
bovisBCG(DansA)mutantsverification.
Thehomo-armsofupstreamanddownstreamregionsofansA,reportermarkergfpandxylE,andcounterselectionmarkersacBwereillustratedintheplasmidpHL084(A).
M.
bovisBCGwt,singlecrossover(SCO)anddoublecrossover(DCO)werescreenedaccordingtoexpressionofXylEandGFP(B).
TheSCOandDCOmutantswerefurtherverifiedbySouthern-blot(C).
2.
2卡介苗分枝杆菌ansA基因缺失株的筛选ansA基因缺失株的构建采用温敏质粒pHL084(图2-A)转化卡介苗分枝杆菌后逐步筛选得到.
基于pHL084质粒的特性,突变株的筛选采用颜色(荧光)和Southern杂交两种方法平行进行.
首先根据菌落在平板上的颜色反应,单交换和双交换菌落在显微镜下都呈现绿色荧光,而野生型菌落不呈现荧光.
其中单交换菌落在喷洒无色的邻苯二酚之后,将在5min之内变为黄褐色(图2-B,SCO/XylE),而野生型和双交换菌株不发生颜色变化,由此可以在平板上几百个克隆中快速锁定阳性克隆.
单交换和双交换突变株的进一步确认采用Southern杂交方0741蔡潇浪等:天冬酰胺酶介导的分枝杆菌酸适应机制.
/微生物学报(2012)52(12)法.
在尼龙膜上,野生型和双交换都仅出现一条带,而单交换有两条带,其中单交换的一条带与野生型大小一致(图2-C),双交换条带比野生型小.
Southern杂交结果表明(图2-C):ansA缺失株构建正确.
2.
3卡介苗分枝杆菌在酸性培养基中对天冬酰胺的利用结核分枝杆菌可以在宿主巨噬细胞内的酸性环境中长期存活.
在这种特定的微环境中,分枝杆菌需要从宿主细胞中获取其赖以生存的营养物质.
我们在前期工作中发现结核分枝杆菌在酸性培养基中仅能利用天冬酰胺、天冬氨酸、谷氨酸和谷氨酰胺四种氨基酸,同时产生碱性物质伴随培养液pH升高[7],其中氨的产生与天冬酰胺有关.
我们猜测,氨可能来自于天冬酰胺酶对天冬酰胺的降解作用.
为此,我们对卡介苗天冬酰胺酶缺失株、突变株和互补株在HdB(pH5.
5)培养基中的生长、pH和氨的动态变化进行了分析.
结果表明:当天冬酰胺酶基因被敲除后,卡介苗在分枝杆菌中的生长大大减弱,与野生型相比在液体培养基中滞后了大约10天(图3-A,Mut.
),而且突变株的生长伴随着pH的升高(图3-B)和氨的产生(图3-C),但与野生型相比明显滞后了10天左右.
这说明分支杆菌在酸性环境中的生长需要中和环境中的H+,而中和H+需要产生碱性物质;如果不能中和H+,分支杆菌将失去在酸性环境中的生长能力,这一点与我们的前期结果完全一致[7].
在本实验中,HdB培养基的唯一氮源为天冬酰胺,因此可以确定氨来自于天冬酰胺酶对天冬酰胺的分解.
但是分解的氨,是否能够完全中和溶液中的H+并引起溶液pH升高呢为此,我们直接对HdB(pH5.
5)进行了酸碱滴定实验.
我们发现,将HdB液体培养基从pH5.
5滴定到pH7.
5时,大约需要16mmol/L的氨水(图3-D).
在本实验中,HdB培养基中天冬酰胺的浓度为15mmol/L,在分枝杆菌存在的条件下,最高可以检测到大约20-25mmol/L的氨(接近理论值30mmol/L),并且当氨的产生达到峰值时,pH的升高也达到峰值.
随后氨的浓度逐渐下降,pH也逐渐下降.
这说明在培养后期,分泌到细胞外的氨又重新被分枝杆菌当做氮源利用,这一点也与本实验室的前期研究结果一致[7].
有趣的是,天冬酰胺酶被敲除后,卡介苗分枝杆菌的生长并没有彻底停止,这说明分枝杆菌还有其它产生氨或者碱性物质的备用途径(见讨论部分).
图3卡介苗分枝杆菌天冬酰胺酶突变株菌落的抗酸生长Fig.
3GrowthcapabilityofansAknockedoutM.
bovisBCGinacidicmedium.
OD600(A),pH(B)andammonia(C)weremeasuredasdescribedintext.
TitrationofHdB(pH5.
5)mediumwascarriedoutbyadditionofammoniaandpHwasquantified(D).
wt:wildtypeM.
bovisBCG;Mut.
:M.
bovisBCG(DansA);Comp.
:ComplementedstrainoftheM.
bovisBCG(DansA).
1741XiaolangCaietal.
/ActaMicrobiologicaSinica(2012)52(12)2.
4分枝杆菌抗酸生长代谢示意图本研究中我们证实了卡介苗分枝杆菌通过天冬酰胺酶分解天冬酰胺产生氨进行抗酸生长,在前期研究中我们发现结核分枝杆菌产生的天冬酰胺通过外膜蛋白OmpATb释放到培养液中[7].
除了天冬酰胺酶代谢通路之外,分枝杆菌还存在其它产氨机制.
同样,除了OmpATb之外,分枝杆菌可能还需要借助其它分泌蛋白将氨分泌到细胞外,为了进一步从全局代谢水平了解结核分枝杆菌的抗酸机制,结合目前已有知识,我们绘制了结核分子杆菌中氨的产生机制示意图(图4-A,相关蛋白命名参照结核分枝杆菌H37Rv实验室菌株).
由于卡介苗分枝杆菌和结核分枝杆菌基因组同源性99.
9%以上,因此该示意图对两个菌都适用,二者在酸性培养基中仅能利用天冬酰胺(Asn)、天冬氨酸(Asp)、谷氨酸(Glu)或谷氨酰胺(Gln)(图4-B).
图4-B为卡介苗分枝杆菌在HdB(pH5.
5)中的生长曲线;关于结核分枝杆菌在HdB(pH5.
5)中的生长曲线见文献[7].
图4分枝杆菌氨产生机制和抗酸示意图Fig.
4Demonstrationofammoniagenerationandgrowthofmycobacteriainacidicmedium.
A:Theconceptmodelofammoniagenerationandsecretionbymycobacteria.
IM:Innermembrane;OM:outermembrane;Asn(Asparagine);AnsA(Asparaginase),AnsB(Asparaginesynthetase);Asp(Aspartate);AspC(Aspartateaminotransferase);Glu(Glutamicacid);Glutamine(Gln);GlnA1/A2/A4(GlutaminesynthetaseA1/A2/A4);Amt(Ammoniatransporter);GlnB(PIIprotein).
B:GrowthofM.
bovisBCGinHdB(pH5.
5)mediumsupplementedwithAsn,Glu,Asp,Gln,Arg,orNitrate(NO-3)asthesolenitrogensource.
Curvesfromother15naturalaminoacidswereexcludedduetoinvisiblegrowth.
Doublingtime(d)foreachnitrogensourceisindicatedasshown.
3讨论在静止期的巨噬细胞中,结核分枝杆菌可以阻碍吞噬小体和溶酶体的融合.
但是,在γ-IFN等细胞因子的刺激下,吞噬小体可以加速和溶酶体融合,并释放各种因子试图"清除"入侵的结核分枝杆菌,包括:超氧离子、泛素肽、金属离子[11-12]、水解酶、质子流等[6].
但是结核分枝杆菌也在进化中形成了"反清除"机制.
其中,酸适应几乎是所有通过呼吸道和消化道感染的致病菌采取的"反清除"策略之一.
在酸性条件下,结核分枝杆菌内一些与破坏宿主溶酶体相关的基因表达会上调,包括:aprA/B/C系统(AcidandphagosomeregulatedA/B/C)[13]以及可以引起溶酶体膜裂解的ESAT-6(Earlysecretedantigen-6)[14]、Mg2+转运蛋白[6](MgtC)和膜蛋白Rv3671c等[15],同时分枝杆菌还产生碱性物质中和微环境中的酸性.
在中性培养基中,结核分枝杆菌和卡介苗分枝杆菌可以利用除了天冬酰胺、天冬氨酸、谷氨酰胺和谷氨酸之外的多种氨基酸(如:精氨酸、丝氨酸)和硝酸盐;但是在酸性培养基中只能利用天冬酰胺、天冬氨酸、谷氨酰胺和谷氨酸,并伴随溶液pH的升高.
这是因为分枝杆菌在精氨酸、丝氨酸和硝酸盐代谢中不能产生碱性物质,因此无法中和酸性环境(图4-B).
有趣的是我们仅在以天冬酰胺为唯一氮源的培养基中检测到了氨的存在.
对于以天冬氨酸(Asp)、谷氨酸(Glu)或谷氨酰胺(Gln)为唯一氮源的培养基,虽然我们发现当分枝杆菌生长后,培养液pH也升高,但是我们检测不到2741蔡潇浪等:天冬酰胺酶介导的分枝杆菌酸适应机制.
/微生物学报(2012)52(12)氨.
这说明当以天冬氨酸、谷氨酸或谷氨酰胺为唯一氮源时,分枝杆菌产生了另外一种不同于氨的碱性物质我们曾经利用质谱和核磁共振对培养液进行了分析,但都找不到在以天冬氨酸(Asp)、谷氨酸(Glu)或谷氨酰胺(Gln)为唯一氮源的条件下,足以引起pH升高的碱性物质(结果未列出).
那么,是不是在以天冬氨酸(Asp)、谷氨酸(Glu)或谷氨酰胺(Gln)为唯一氮源时,虽然不产生碱性物质,但是分枝杆菌过多的消耗了细胞外的H+而导致了pH升高呢或者说胞外的H+通过质子泵运送到胞内后,和胞内产生的NH3结合生成NH4+(图4A),胞内的NH4+来不及输送到细胞外,就被细胞利用产生其他氨基酸呢关于这一解释,目前尚缺乏直接的实验证据.
其实,结核分枝杆菌利用天冬酰胺作为氮源产生氨,早在50年前就有报道[16-17],但是当时基于分子生物学发展的局限和基因组信息的缺乏,研究人员只是发现了这种产氨现象,但对于天冬酰胺的代谢机理和氨的作用机制并没有进行深入的研究.
直到1980年,Gordon等[18]人在《Nature》杂志上发文表明,氨在结核分枝杆菌感染的巨噬细胞内可以阻止溶酶体和吞噬小体的融合,并指出分枝杆菌中的氨可能来自于氨基类物质的代谢.
后来越来越多的证据表明:结核分枝杆菌产生的氨是其抗酸生长和影响破坏巨噬细胞溶酶体和吞噬小体融合的关键因素[19],而且分枝杆菌中氨转运受到多基因调控[20].
近期,我们在研究中也发现结核分枝杆菌产生的氨可能通过OmpATb(Rv0899)分泌到细胞外[7],这一发现很快被国外同行认可,并拓展成Rv0899的结构在固氮细菌中普遍存在[21],并与氨的分泌有关.
通过比较基因组学发现,天冬酰胺酶广泛存在于多种细菌中(比如:大肠杆菌).
为何结核分枝杆菌利用天冬酰胺酶分解天冬酰胺,产生的氨能够分泌到细胞外,且能引起液体培养基中pH升高,而大肠杆菌等却没有发现这种现象可能的原因有:(1)结核分枝杆菌为慢性生长菌(复制一代需要约18-24h),体内物质合成速度较慢,但是天冬酰胺酶活性很高(图1-C),并能在短时间内产生大量的氨,为了避免氨的累积对细胞的损伤,因此多余的氨将被释放到细胞外.
而大肠杆菌等快速生长菌(复制一代需要30-40min或1-2h),体内代谢活动旺盛,产生的氨很快参与到细胞内氨基酸的合成代谢活动中,体内不存在氨的累积现象,因此分泌到细胞外的氨数量几乎为零.
(2)在酸性环境中,不同的细菌抗酸机制是不一样的.
比如:沙门氏菌通过质子泵F1F0ATPase维持细胞内的酸碱平衡[22];幽门螺杆菌通过尿素酶分解尿素产生的氨来中和消化道内的酸性环境[23];血链球菌(Streptococcussanguis)通过分解精氨酸产生氨[24].
而在本文中,分枝杆菌可以利用天冬酰胺产生氨.
因此,氨的产生是细菌抗酸生长的特性之一.
根据结核分枝杆菌特有的、而在其他革兰氏阳性菌中不具备的细胞双层膜结构[25],我们绘制了天冬酰胺介导的氨产生示意图(图4-A).
该示意图的依据如下:(1)一般来说,革兰氏阳性菌只有一层膜,不存在外膜和内膜之分.
但是,结核分枝杆菌是革兰氏阳性菌中的特例,具有类似于革兰氏阴性菌的内膜和外膜[25],因此该示意图为双层膜结构;(2)氨为小分子物质,可以穿过细胞的磷脂双层膜[26],因此氨在胞内和胞外均出现;(3)氨转运蛋白Amt为内膜蛋白,在三界(Kingdom)生物中都存在[27],因此在内膜位置体现了Amt/GlnB复合体;(4)我们在前期研究中发现,外膜蛋白OmpATb也参与了氨的转运[7];因此在外膜位置体现了OmpATb;(5)天冬酰胺的转运蛋白Rv2127和Rv0346c源自基因组注释,可能为内膜蛋白,因此天冬酰胺的转运体现了这两种蛋白.
至于是否还需要其它外膜蛋白协助尚不清楚,因此用""表示;(6)天冬酰胺(Asn)、天冬氨酸(Asp)、谷氨酸(Glu)、谷氨酰胺(Gln)在分枝杆菌细胞内存在互换循环依据来自于BioCyc数据库对结核分枝杆菌代谢途径的注释(http://www.
biocyc.
com/MTBRV/NEW-IMAGEtype=PATHWAY&object=ASPASN-PWY).
在该示意图中,天冬酰胺(Asn)通过膜蛋白被转运到细胞内,在天冬酰胺酶(AnsA)的作用下产生氨(NH3)和天冬氨酸(Asp).
但是将天冬酰胺酶基因敲除后,将卡介苗分枝杆菌培养18天后仍然能检测到氨的存在,这说明天冬酰胺还有产生氨的备用途径,或许通过草酰琥珀酸盐(2-oxosuccinamate)途3741XiaolangCaietal.
/ActaMicrobiologicaSinica(2012)52(12)径(图4-A).
结核分枝杆菌在酸性条件下可以利用的四种氨基酸:天冬酰胺(Asn)、天冬氨酸(Asp)、谷氨酸(Glu)或谷氨酰胺(Gln)在分枝杆菌细胞内存在互换循环.
在以天冬酰胺为唯一氮源时,多余的氨通过氨转运内膜蛋白Amt/GlnB复合体[28-29]和外膜蛋白OmpATb[7]等输送到分枝杆菌细胞外.
至于结核分枝杆菌中是否存在类似于耻垢分枝杆菌中的穿孔外膜蛋白(porin),该蛋白在不需要任何能量的条件下可以转运氨基酸、糖、无机盐等各种亲水物质[30],目前尚不清楚.
本研究通过天冬酰胺酶首次揭示了分枝杆菌的产氨机理,产生的氨可以将周围的酸性环境中和,这为今后进一步通过感染细胞生物学实验研究分枝杆菌在巨噬细胞内的抗酸和在溶酶体、吞噬小体内的定位和迁移机制奠定了基础.
参考文献[1]WHOreport2011globaltuberculosiscontrol.
2011:1-246.
[2]SchaibleUE,Sturgill-KoszyckiS,SchlesingerPH,RussellDG.
CytokineactivationleadstoacidificationandincreasesmaturationofMycobacteriumavium-containingphagosomesinmurinemacrophages.
JournalofImmunology,1998,160(3):1290-1296.
[3]SidebothamRL,BaronJH.
Hypothesis:Helicobacterpylori,urease,mucus,andgastriculcer.
Lancet,1990,335(8683):193-195.
[4]OsawaR,OkitsuT,MorozumiH,YamaiS.
Occurrenceofurease-positiveVibrioparahaemolyticusinKanagawa,Japan,withspecificreferencetopresenceofthermostabledirecthemolysin(TDH)andtheTDH-related-hemolysingenes.
AppliedandEnvironmentalMicrobiology,1996,62(2):725-727.
[5]ChenJ,ChengC,XiaY,ZhaoH,FangC,ShanY,WuB,FangW.
Lmo0036,anornithineandputrescinecarbamoyltransferaseinListeriamonocytogenes,participatesinargininedeiminaseandagmatinedeiminasepathwaysandmediatesacidtolerance.
Microbiology,2011,157(Pt11):3150-3161.
[6]VandalOH,NathanCF,EhrtS.
AcidresistanceinMycobacteriumtuberculosis.
JournalofBacteriology,2009,191(15):4714-4721.
[7]SongH,HuffJ,JanikK,WalterK,KellerC,EhlersS,BossmannSH,NiederweisM.
ExpressionoftheompATboperonacceleratesammoniasecretionandadaptationofMycobacteriumtuberculosistoacidicenvironments.
MolecularMicrobiology,2011,80(4):900-918.
[8]SongH,WolschendorfF,NiederweisM.
Constructionofunmarkeddeletionmutantsinmycobacteria.
InT.
Parish,andA.
Brown(Eds):Mycobacteriaprotocols.
HumanaPress,Ottawa,2008,279-295.
[9]StephanJ,StemmerV,NiederweisM.
ConsecutivegenedeletionsinMycobacteriumsmegmatisusingtheyeastFLPrecombinase.
Gene,2004,343:181-190.
[10]SmeuldersMJ,KeerJ,SpeightRA,WilliamsHD.
AdaptationofMycobacteriumsmegmatistostationaryphase.
JournalofBacteriology,1999,181(1):270-283.
[11]WolschendorfF,AckartD,ShresthaTB,Hascall-DoveL,NolanS,LamichhaneG,WangY,BossmannSH,BasarabaRJ,NiederweisM.
CopperresistanceisessentialforvirulenceofMycobacteriumtuberculosis.
ProceedingsoftheNationalAcademyofSciences,2011,108(4):1621-1626.
[12]BotellaH,PeyronP,LevillainF,PoinclouxR,PoquetY,BrandliI,WangC,TailleuxL,TilleulS,CharriereGM,WaddellSJ,FotiM,Lugo-VillarinoG,GaoQ,Maridonneau-PariniI,ButcherPD,CastagnoliPR,GicquelB,deChastellierC,NeyrollesO.
Mycobacterialp(1)-typeATPasesmediateresistancetozincpoisoninginhumanmacrophages.
CellHostMicrobe,2011,10(3):248-259.
[13]AbramovitchRB,RohdeKH,HsuFF,RussellDG.
aprABC:aMycobacteriumtuberculosiscomplex-specificlocusthatmodulatespH-drivenadaptationtothemacrophagephagosome.
MolecularMicrobiology,2011,80(3):678-694.
[14]RenshawPS,LightbodyKL,VeverkaV,MuskettFW,KellyG,FrenkielTA,GordonSV,HewinsonRG,BurkeB,NormanJ,WilliamsonRA,CarrMD.
StructureandfunctionofthecomplexformedbythetuberculosisvirulencefactorsCFP-10andESAT-6.
TheEMBOJournal,2005,24(14):2491-2498.
[15]VandalOH,PieriniLM,SchnappingerD,NathanCF,4741蔡潇浪等:天冬酰胺酶介导的分枝杆菌酸适应机制.
/微生物学报(2012)52(12)EhrtS.
AmembraneproteinpreservesintrabacterialpHinintraphagosomalMycobacteriumtuberculosis.
NatureMedicine,2008,14(8):849-854.
[16]LongER(1958):Utilizationofnitrogenforgrowth.
InE.
R.
Long(Ed.
):Thechemistryandchemotherapyoftuberculosis.
TheWilliams&WilkinsCompany,London,pp.
80-85.
[17]LyonRH,HallWH,Costas-MartinezC.
EffectofL-asparagineongrowthofMycobacteriumtuberculosisandonutilizationofotheraminoacids.
JournalofBacteriology,1974,117(1):151-156.
[18]GordonAH,HartPD,YoungMR.
Ammoniainhibitsphagosome-lysosomefusioninmacrophages.
Nature,1980,286(5768):79-80.
[19]HmamaZ,GabathulerR,JefferiesWA,deJongG,ReinerNE.
AttenuationofHLA-DRexpressionbymononuclearphagocytesinfectedwithMycobacteriumtuberculosisisrelatedtointracellularsequestrationofimmatureclassIIheterodimers.
JournalofImmunology,1998,161(9):4882-4893.
[20]AmonJ,BrauT,GrimrathA,HansslerE,HasseltK,HollerM,JessbergerN,OttL,SzokolJ,TitgemeyerF,BurkovskiA.
NitrogencontrolinMycobacteriumsmegmatis:nitrogen-dependentexpressionofammoniumtransportandassimilationproteinsdependsontheOmpR-typeregulatorGlnR.
JournalofBacteriology,2008,190(21):7108-7116.
[21]MarassiFM.
MycobacteriumtuberculosisRv0899definesafamilyofmembraneproteinswidespreadinnitrogen-fixingbacteria.
Proteins,2011,79(10):2946-2955.
[22]FosterJW.
Salmonellaacidshockproteinsarerequiredfortheadaptiveacidtoleranceresponse.
JournalofBacteriology,1991,173(21):6896-6902.
[23]SachsG,ScottD,WeeksD,MelchersKN.
TheimportanceofthesurfaceureaseofHelicobacterpylori:factorfictionTrendsinMicrobiology,2001,9(11):532-534.
[24]QuiveyRG,KuhnertWL,HahnK.
Geneticsofacidadaptationinoralstreptococci.
CriticalReviewsinOralBiology&Medicine,2001,12(4):301-314.
[25]HoffmannC,LeisA,NiederweisM,PlitzkoJM,EngelhardtH.
Disclosureofthemycobacterialoutermembrane:Cryo-electrontomographyandvitreoussectionsrevealthelipidbilayerstructure.
ProceedingsoftheNationalAcademyofSciences,2008,105(10):3963-3967.
[26]AntonenkoYN,PohlP,DenisovGA.
Permeationofammoniaacrossbilayerlipidmembranesstudiedbyammoniumionselectivemicroelectrodes.
BiophysicalJournal,1997,72(5):2187-2195.
[27]ZhengL,KostrewaD,BernecheS,WinklerFK,LiXD.
ThemechanismofammoniatransportbasedonthecrystalstructureofAmtBofEscherichiacoli.
ProceedingsoftheNationalAcademyofSciences,2004,101(49):17090-17095.
[28]AmonJ,TitgemeyerF,BurkovskiA.
Agenomicviewonnitrogenmetabolismandnitrogencontrolinmycobacteria.
JournalofMolecularMicrobiologyandBiotechnology,2009,17(1):20-29.
[29]GruswitzF,O'ConnellJ,3rd,StroudRM.
Inhibitorycomplexofthetransmembraneammoniachannel,AmtB,andthecytosolicregulatoryprotein,GlnK,at1.
96A.
ProceedingsoftheNationalAcademyofSciences,2007,104(1):42-47.
[30]SongH,NiederweisM.
UptakeofsulfatebutnotphosphatebyMycobacteriumtuberculosisisslowerthanthatforMycobacteriumsmegmatis.
JournalofBacteriology,2012,194(5):956-964.
5741XiaolangCaietal.
/ActaMicrobiologicaSinica(2012)52(12)AsparaginasemediatedacidadaptationofmycobacteriaXiaolangCai1#,BeibeiWu2#,YangFang1,HouhuiSong1*1CollegeofAnimalScienceandTechnology,ZhejiangAgriculture&ForestryUniversity,Lin'an311300,China2ZhejiangProvincialCenterforDiseaseControlandPrevention,Hangzhou310051,ChinaAbstract:[Objective]Mycobacteriumtuberculosiscansurviveinsidehostcellsforalongtime.
Toelucidatetheacidadaptationmechanismmediatedbytheasparagine(Asn)metabolicpathway,theactivityofasparaginase(AnsA)andgrowthofmycobacteriawerecharacterized.
[Methods]ThenonpathogenicM.
bovisBCGwasusedasamodelstraintocharacterizeAnsAfunction.
TherecombinantAnsAwasfurtherexpressedinE.
coli,purifiedbyCo2+chargedresin,andanalyzedbyenzymaticmethod.
M.
bovisBCGmutant(DansA)wasconstructedbyhomologousrecombination.
ThegrowthandammoniagenerationbyM.
bovisBCGwildtypeandmutantwereevaluatedinacidicmedium.
[Results]AmmoniawasdetectedinthepresenceofAnsAandAsn.
DeletionofansAsignificantlydelayedthegrowthofM.
bovisBCGfor10daysinacidicmedium.
AsnwasusedbyM.
bovisBCGtoproduceammonia,increasingpH.
[Conclusion]TheacidadaptationofM.
bovisBCGwasmediatedbyammonia,themetabolicproductofasparagine.
ThisprovidesnewcluetouncoverthesurvivalmechanismofM.
tuberculosisinsidetheacidicnicheenvironmentofhostmacrophage.
Keywords:M.
bovisBCG,asparagine,asparaginase,acidadaptation(本文责编:张晓丽)SupportedbytheNationalProgramsforHighTechnologyResearchandDevelopmentofChina(2012AA101602),bytheNationalNaturalScienceFoundationofChina(30800014)andbytheZhejiangAgriculture&ForestryUniversityTalentStartingProgram(2034020075)*Correspondingauthor.
Tel:+86-571-63741392;E-mail:songhh@zafu.
edu.
cn#Theseauthorscontributedequallytothiswork.
Received:5June2012/Revised:檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶5July2012科学出版社新书推介(2012年9、10月)中国微生物基因组研究作者:喻子牛,邵宗泽,孙明;ISBN:9787030357236;定价:190;开本:16;装帧:平装;页码:692;初版时间:2012-10-1内容简介:《中国微生物基因组研究》由我国从事微生物基因组研究的专家们结合自己的研究领域撰写的综述论文组成,反映了我国微生物基因组研究的过去、现在,并指出了未来尚需研究的方向.
共分为真细菌基因组(包括人畜病原真细菌,农用真细菌,环境真细菌,冶金、食品真细菌基因组)、古生菌基因组、真核微生物基因组、病毒基因组、微生物基因组研究方法五个部分.
订购方式1:网上购书淘宝商城科学出版社旗舰店:http://kxcbs.
tmall.
com/卓越亚马逊:http://www.
amazon.
cn/当当网:http://www.
dangdang.
com/京东图书:http://book.
360buy.
com/订购方式2:电话购书联系人:科学出版社贾海涛13501022258010-64017321订购方式3:邮件购书生物分社:lifescience@mail.
sciencep.
com;贾海涛:jiahaitao@mail.
sciencep.
com6741
im.
ac.
cn/actamicrocn基金项目:国家"863计划"(2012AA101602);国家自然科学基金(30800014);浙江农林大学人才项目(2034020075)*通信作者.
Tel:+86-571-63741392;E-mail:songhh@zafu.
edu.
cn作者简介:#共同第一作者.
蔡潇浪(1991-),男,浙江瑞安人,学士,主要从事病原微生物遗传学研究.
吴蓓蓓(1979-),女,浙江苍南人,博士,副研究员,主要从事结核分枝杆菌病原学研究.
收稿日期:2012-06-05;修回日期:2012-07-05天冬酰胺酶介导的分枝杆菌酸适应机制蔡潇浪1#,吴蓓蓓2#,方扬1,宋厚辉1*1浙江农林大学动物科技学院,临安3113002浙江省疾病预防控制中心,杭州310051摘要:【目的】结核分枝杆菌可以在宿主细胞内的酸性环境中长期存活.
为了探明天冬酰胺酶(AnsA)代谢通道介导的分枝杆菌在酸性环境中的适应机制,分别通过体内和体外实验,对AnsA的活性、突变体性质进行了分析.
【方法】以无致病性的卡介苗分枝杆菌(M.
bovisBCG)为模式菌,扩增天冬酰胺酶编码基因ansA并在大肠杆菌中进行表达和纯化,对AnsA的酶学活性进行了分析.
在卡介苗分枝杆菌中将ansA敲除,对其抗酸、产氨等特性进行了研究.
【结果】纯化的重组AnsA在体外可以将天冬酰胺分解并产生氨.
在酸性培养基中,分枝杆菌利用天冬酰胺产生的氨,可以释放到培养基中,将酸性培养基中和.
敲除ansA后,卡介苗分枝杆菌在酸性环境中的生长滞后10天左右.
为了更好的理解天冬酰胺介导的抗酸机制,绘制了天冬酰胺代谢、氨产生和转运示意图.
【结论】结核分枝杆菌的抗酸特性之一是通过分泌氨将周围的酸性环境中和来实现的.
氨来源于分枝杆菌AnsA对底物天冬酰胺的分解.
这为揭示结核分枝杆菌在宿主巨噬细胞内酸性环境中的生存机制提供了线索.
关键词:卡介苗分枝杆菌,天冬酰胺,天冬酰胺酶,酸适应性中图分类号:Q935文献标识码:A文章编号:0001-6209(2012)12-1467-10结核分枝杆菌(Mycobacteriumtuberculosis,Mtb)是引起肺结核(Tuberculosis,TB)的致病菌,目前全球大约有1/3人口为结核阳性.
根据WHO最新报告,2010年全球大约有145万人口死于TB[1],其中我国人口结核的感染率居世界第二.
结核分枝杆菌在宿主体内主要感染巨噬细胞,属于胞内寄生菌且能在宿主细胞酸性溶酶体和吞噬小体内的微环境(pH5.
5左右或者更低)中长期存活[2],因此对其抗酸机制的了解是阐明其致病和耐药机制的前提.
但是,不同的细菌在进化中形成的抗酸机制不同.
比如:胞外菌幽门螺杆菌(Helicobacterpylori)和副溶血弧菌(Vibrioparahaemolyticus)进入宿主体内之后,可以通过自身的尿素酶将尿素分解并将产生的氨释放到细菌细胞外,迅速中和消化道内的酸性环境来实现其抗酸生长,同时利用氨破坏上皮细胞[3-4].
而胞内寄生菌单核细胞增多性李斯特菌(Listeriamonocytogenes)则通过精氨酸脱亚氨酶对精氨酸的脱氨基作用适应宿主酸性环境[5].
慢性生长的结核分枝杆菌与其它快速生长的胞内和胞外菌又有所不同,因为结核分枝杆菌需要在酸性环境中存活数月或者数年,在特定的宿主巨噬细胞内即需要抵抗来自宿主细胞的各XiaolangCaietal.
/ActaMicrobiologicaSinica(2012)52(12)种杀伤因子(如:超氧离子、细胞因子等)[6],还需要从环境中获取营养维持自身生存,更需要耐受来自溶酶体或吞噬溶酶体的酸应激.
那么,结核分枝杆菌是如何适应周围的酸性环境呢我们在前期的研究工作中发现:结核分枝杆菌能够利用天冬酰胺产生氨,且通过外膜蛋白OmpATb输送到细菌细胞外[7].
为了进一步阐明"氨"和分枝杆菌的抗酸机制,在本研究中,我们利用无致病性的卡介苗分枝杆菌为模式菌,通过模拟酸性环境和氮源,我们发现卡介苗分枝杆菌产生的氨来自天冬酰胺酶对天冬酰胺的降解作用,这是目前揭示分枝杆菌抗酸机制的最新发现.
1材料和方法1.
1材料1.
1.
1化学试剂、菌株和质粒:本实验室所用的化学试剂均为分析纯,购自Sigma、USP和BD等公司.
卡介苗分枝杆菌(M.
bovisBCG)由本实验室的合作实验室(阿拉巴马大学Niederweis实验室)提供.
大肠杆菌克隆用菌株为DH5a.
质粒pHL002(ansA表达载体)、pHL084(ansA基因敲除载体)由本实验室构建并保存.
其中pHL002是pET28(b)的衍生质粒,pHL084是pML564的衍生质粒[7].
质粒图谱分别如图1和图2所示.
1.
1.
2细菌培养:大肠杆菌培养基为LB培养基,37℃培养.
卡介苗分枝杆菌培养基为7H9/OADC培养基(液体)和7H10/OADC培养基(固体),37℃培养.
筛选用抗生素浓度:Hygromycin(潮霉素,50-200μg/mL).
1.
2卡介苗分枝杆菌ansA原核表达载体和基因敲除载体的构建1.
2.
1ansA原核表达载体:本研究所用的引物名称和序列如表1所示.
采用ansAfwd/ansAHisRev引物从卡介苗分枝杆菌基因组中扩增ansA基因,利用NcoI/HindI酶切位点连入pET28(b)中,命名为pHL002.
卡介苗分枝杆菌与结核分枝杆菌(H37Rv)的ansA同源性100%.
1.
2.
2ansA基因敲除载体的构建:采用ansAusfwd/ansAusrev引物从卡介苗分枝杆菌基因组中扩增ansA上游同源臂(1069bp),利用SpeI/SwaI酶切位点连入pML523中,命名为pHL083.
然后采用ansAdsfwd/ansAdsrev引物从卡介苗分枝杆菌基因组中扩增ansA下游同源臂(1014bp),利用PacI/NsiI酶切位点连入pHL083中,命名为pHL084.
所有插入片段均经过测序验证序列的正确性.
表1引物名称和序列Table1PrimersusedinthisstudyPrimerSequence(5'→3')ansAfwdAACCATGGGAGCAAACCACGTGCGCansAHisRevGCAAGCTTCAGTGGTGGTGGTGGTGGTGGCCCCAACGGTCGATGACGTCGansAusfwdTGGACTAGTACGTCGAGACGTTCTGCGAACGGTTansAusrevCGCATTTAAATAACTCACCGGTCGCCGACGTCATCGAansAdsfwdTGGTTAATTAATGTCCCTCCAGTAGTGATGACGGTGAansAdsrevTGTATGCATAACGATGTCGTCGTCGGAATACAGAAT1.
3ansA基因敲除和筛选步骤将pHL084质粒(该质粒为温度敏感型质粒,当温度高于39℃时停止复制)转化入卡介苗分枝杆菌感受态细胞中,在7H10/OADC/Hyg平板上筛选,用锡箔纸密封后于35℃培养.
3-4周后,挑选平板上任一单菌落,在7H9/OADC/Hyg液体培养基中摇菌,待OD600达到1.
0左右时候然后稀释成浓度1∶10-1-10-6,涂布7H10/OADC/Hyg平板,用锡箔纸密封后于39℃培养.
3-4周后,挑选平板上单菌落进行菌落PCR和Southern杂交验证,此时在基因组水平上发生同源重组:单交换(Singlecrossover,SCO).
然后将任一单交换克隆,在7H9/OADC/Hyg液体培养基中摇菌,至OD600达到1.
0时,按照1∶10-1-10-6稀释,涂布7H10/OADC/Hyg/2%Sucrose平板,用锡箔纸密封后于39℃培养.
3-4周后,利用荧光(鉴定方法见1.
8)和Southern杂交验证,此时在基因组水平上发生双交换(Doublecrossover,DCO).
在双交换菌株中,ansA被hyg-gfp替代.
其中,hyg为潮霉素抗性基因,gfp为绿色荧光蛋白基因.
我们这样构建突变株的目的是为了得到ansA基因缺失株的同时,也得到能够表达绿色荧光蛋白的标记株,优点是可以在后续的细胞实验中,追踪细菌在巨噬细胞中的定位.
采用这种策略构建基因缺失株的前提是ansA和及其上下游的基因不能属于同一个操纵子.
这一点,我们已经通过网络服务器对ansA及其上下游基因进行了操纵子预测(http://www.
microbesonline.
org/about_operon.
8641蔡潇浪等:天冬酰胺酶介导的分枝杆菌酸适应机制.
/微生物学报(2012)52(12)html),证实了ansA及其上下游基因不属于操纵子,因此本实验采用的构建策略不存在潜在的极性效应.
1.
4卡介苗分枝杆菌感受态细胞的制备卡介苗分支杆菌感受态的制备方法采用本实验室报道的方法进行[8].
即:将分枝杆菌在100mL7H9/OADC液体培养基中培养至OD600为0.
5,离心收获菌体,用10%预冷的甘油将菌体洗涤3次,最后用1mL10%甘油悬浮菌体(感受态细胞).
电穿孔转换参数为:1000Ω,2.
5kV,25μF.
电击杯宽度为4mm.
1.
5天冬酰胺酶的表达和纯化天冬酰胺酶在大肠杆菌中的表达和纯化参照本实验室报道的方法进行[7].
即:将pHL002转化入大肠杆菌Rosetta感受态细胞中,用0.
1mmol/LIPTG诱导过夜(16℃).
采用超声波方法破碎细胞,利用Co2+树脂(BD公司)纯化AnsAHis.
1.
6天冬酰胺酶活性分析在100μLPBS(pH7.
2)缓冲液中,加入2.
5mmol/L天冬酰胺为底物和3μg纯化的天冬酰胺酶.
如果天冬酰胺酶具有活性,将分解天冬酰胺产生氨.
产生的氨在溶液中以NH4+离子形式存在,利用德国拜发公司的氨检测试剂盒检测溶液中氨的浓度,操作步骤按照试剂盒说明书进行.
该方法的原理是氨可以和试剂盒提供的2-氧戊二酸盐(2-oxoglutarate)反应生成谷氨酸盐,同时将NADH氧化成NAD,其中NADH对340nm的吸收度与氨的浓度成线性关系,因此可以定量检测反应液或者培养基中氨的浓度.
1.
7Southern杂交利用Southern杂交鉴定基因缺失株采用文献报道的方法进行[9].
其中探针为ansA上游同源臂,标记采用地高辛方法(Roche公司),探针标记和检测参照试剂盒提供的说明书进行.
卡介苗分枝杆菌基因组利用NruI酶切后采用真空转印法到杂交膜上,显色采用NBT/BCIP.
1.
8报告基因检测ansA基因敲除载体pHL084含有两个报告基因,分别为xylE和gfp.
其中xylE为儿茶酚双加氧酶基因,表达产物可以将无色的邻苯二酚(Catechol)氧化成黄褐色的醌类物质,菌落在平板上表现为黄褐色.
gfp为绿色荧光蛋白编码基因,菌落在平板上表现为绿色荧光.
ansA基因单交换株在邻苯二酚存在的条件下表现为肉眼可见的黄褐色,荧光显微镜下为绿色荧光.
双交换株在邻苯二酚存在的条件下不发生任何颜色变化,但为绿色荧光.
通过菌落在平板上的颜色转换可以快速区分单交换和双交换,加速基因缺失株的筛选过程.
筛选用的邻苯二酚浓度为100mmol/L,用50mmol/L的磷酸钾缓冲液(pH7.
2)配制,于4℃避光保存,使用时直接滴在菌落或者喷洒在菌落上面.
GFP荧光菌落利用Olympus荧光体视显微镜(SZX-16)进行观察和照片拍摄.
1.
9卡介苗在酸性培养基中的氮源利用实验利用HdB[10]培养基为基础培养基,碳源为甘油,氮源为15mmol/L天冬酰胺,pH为5.
5.
卡介苗种子液先在7H9/OADC/Tween80培养基中培养至OD600约为2-3.
然后离心收集菌体,并用灭菌水(含0.
1%Tween80)洗涤3次,去除原始培养基中的营养成分,转接于250mL上述HdB培养基中,起始OD600为0.
01,连续培养4周,每天取1mL检测OD600、pH和氨的浓度.
其中pH和氨的浓度检测需要将菌液用0.
2μm滤器过滤后取无菌滤液进行.
pH检测采用酸度计(VWR),氨的浓度检测采用酶动力学方法(见1.
6).
2结果2.
1天冬酰胺酶在大肠杆菌中的表达、纯化和活性分析为了检测天冬酰胺酶的活性,首先我们构建了分枝杆菌天冬酰胺酶原核表达载体为pHL002(图1-A),并在大肠杆菌中对卡介苗分枝杆菌天冬酰胺酶进行了表达,并用Co2+树脂对表达产物进行了纯化.
结果表明:分枝杆菌天冬酰胺酶在大肠杆菌中以可溶性形式进行表达,不形成包涵体(图1-B).
从超声波裂解物的上清液中纯化的rAnsAHis在SDS-PAGE胶上为单一条带,大小与预期完全一致,且能把天冬酰胺分解产生氨(图1-C),这说明纯化的天冬酰胺酶具有生物学活性.
此外,由于在本实验进行期间,缺乏天冬酰胺酶抗体进行Western验证,我们直接将图1C中纯化的34kDa的蛋白条带从胶上切割下来,胰酶处理后,送往中科院上海生化细胞所蛋白质组研究分析中心进行质谱分析,结果表明纯9641XiaolangCaietal.
/ActaMicrobiologicaSinica(2012)52(12)化的rAnsAHis可以被胰酶切割成11个肽段,肽段序列可以完全映射到AnsA的参考蛋白序列上(图1-D),说明大肠杆菌表达的重组天冬酰胺酶完全正确.
图1天冬酰胺酶在大肠杆菌中的表达、纯化和活性分析Fig.
1Expression,purificationandenzymaticcharacterizationofAnsA.
A:TheansAgenefromM.
bovisBCGwasclonedintopET28(b)vectorunderT7promoterviaNcoI/HindIII.
B:SDS-PAGEseparationofthepurifiedrAnsAHis.
C:EnzymaticactivityofthepurifiedAnsA(Asparaginase)inthepresenceofasparagine.
Ammoniaconcentrationinthesesampleswasdeterminedusinganenzymaticmethodbasedonthesynthesisofglutamatefrom2-oxoglutarateandammoniabyglutamatedehydrogenase.
D:TypsintreatedrAnsAHis(fromFig.
1B)wasanalyzedbyLCQ/LTQmassspectrometer.
Peptidefragments(P1-P11)weremappedtoAnsAreferenceproteinbyBuildSummarysoftware.
图2卡介苗分枝杆菌突变株菌落的荧光鉴定Fig.
2PlasmidconstructionandM.
bovisBCG(DansA)mutantsverification.
Thehomo-armsofupstreamanddownstreamregionsofansA,reportermarkergfpandxylE,andcounterselectionmarkersacBwereillustratedintheplasmidpHL084(A).
M.
bovisBCGwt,singlecrossover(SCO)anddoublecrossover(DCO)werescreenedaccordingtoexpressionofXylEandGFP(B).
TheSCOandDCOmutantswerefurtherverifiedbySouthern-blot(C).
2.
2卡介苗分枝杆菌ansA基因缺失株的筛选ansA基因缺失株的构建采用温敏质粒pHL084(图2-A)转化卡介苗分枝杆菌后逐步筛选得到.
基于pHL084质粒的特性,突变株的筛选采用颜色(荧光)和Southern杂交两种方法平行进行.
首先根据菌落在平板上的颜色反应,单交换和双交换菌落在显微镜下都呈现绿色荧光,而野生型菌落不呈现荧光.
其中单交换菌落在喷洒无色的邻苯二酚之后,将在5min之内变为黄褐色(图2-B,SCO/XylE),而野生型和双交换菌株不发生颜色变化,由此可以在平板上几百个克隆中快速锁定阳性克隆.
单交换和双交换突变株的进一步确认采用Southern杂交方0741蔡潇浪等:天冬酰胺酶介导的分枝杆菌酸适应机制.
/微生物学报(2012)52(12)法.
在尼龙膜上,野生型和双交换都仅出现一条带,而单交换有两条带,其中单交换的一条带与野生型大小一致(图2-C),双交换条带比野生型小.
Southern杂交结果表明(图2-C):ansA缺失株构建正确.
2.
3卡介苗分枝杆菌在酸性培养基中对天冬酰胺的利用结核分枝杆菌可以在宿主巨噬细胞内的酸性环境中长期存活.
在这种特定的微环境中,分枝杆菌需要从宿主细胞中获取其赖以生存的营养物质.
我们在前期工作中发现结核分枝杆菌在酸性培养基中仅能利用天冬酰胺、天冬氨酸、谷氨酸和谷氨酰胺四种氨基酸,同时产生碱性物质伴随培养液pH升高[7],其中氨的产生与天冬酰胺有关.
我们猜测,氨可能来自于天冬酰胺酶对天冬酰胺的降解作用.
为此,我们对卡介苗天冬酰胺酶缺失株、突变株和互补株在HdB(pH5.
5)培养基中的生长、pH和氨的动态变化进行了分析.
结果表明:当天冬酰胺酶基因被敲除后,卡介苗在分枝杆菌中的生长大大减弱,与野生型相比在液体培养基中滞后了大约10天(图3-A,Mut.
),而且突变株的生长伴随着pH的升高(图3-B)和氨的产生(图3-C),但与野生型相比明显滞后了10天左右.
这说明分支杆菌在酸性环境中的生长需要中和环境中的H+,而中和H+需要产生碱性物质;如果不能中和H+,分支杆菌将失去在酸性环境中的生长能力,这一点与我们的前期结果完全一致[7].
在本实验中,HdB培养基的唯一氮源为天冬酰胺,因此可以确定氨来自于天冬酰胺酶对天冬酰胺的分解.
但是分解的氨,是否能够完全中和溶液中的H+并引起溶液pH升高呢为此,我们直接对HdB(pH5.
5)进行了酸碱滴定实验.
我们发现,将HdB液体培养基从pH5.
5滴定到pH7.
5时,大约需要16mmol/L的氨水(图3-D).
在本实验中,HdB培养基中天冬酰胺的浓度为15mmol/L,在分枝杆菌存在的条件下,最高可以检测到大约20-25mmol/L的氨(接近理论值30mmol/L),并且当氨的产生达到峰值时,pH的升高也达到峰值.
随后氨的浓度逐渐下降,pH也逐渐下降.
这说明在培养后期,分泌到细胞外的氨又重新被分枝杆菌当做氮源利用,这一点也与本实验室的前期研究结果一致[7].
有趣的是,天冬酰胺酶被敲除后,卡介苗分枝杆菌的生长并没有彻底停止,这说明分枝杆菌还有其它产生氨或者碱性物质的备用途径(见讨论部分).
图3卡介苗分枝杆菌天冬酰胺酶突变株菌落的抗酸生长Fig.
3GrowthcapabilityofansAknockedoutM.
bovisBCGinacidicmedium.
OD600(A),pH(B)andammonia(C)weremeasuredasdescribedintext.
TitrationofHdB(pH5.
5)mediumwascarriedoutbyadditionofammoniaandpHwasquantified(D).
wt:wildtypeM.
bovisBCG;Mut.
:M.
bovisBCG(DansA);Comp.
:ComplementedstrainoftheM.
bovisBCG(DansA).
1741XiaolangCaietal.
/ActaMicrobiologicaSinica(2012)52(12)2.
4分枝杆菌抗酸生长代谢示意图本研究中我们证实了卡介苗分枝杆菌通过天冬酰胺酶分解天冬酰胺产生氨进行抗酸生长,在前期研究中我们发现结核分枝杆菌产生的天冬酰胺通过外膜蛋白OmpATb释放到培养液中[7].
除了天冬酰胺酶代谢通路之外,分枝杆菌还存在其它产氨机制.
同样,除了OmpATb之外,分枝杆菌可能还需要借助其它分泌蛋白将氨分泌到细胞外,为了进一步从全局代谢水平了解结核分枝杆菌的抗酸机制,结合目前已有知识,我们绘制了结核分子杆菌中氨的产生机制示意图(图4-A,相关蛋白命名参照结核分枝杆菌H37Rv实验室菌株).
由于卡介苗分枝杆菌和结核分枝杆菌基因组同源性99.
9%以上,因此该示意图对两个菌都适用,二者在酸性培养基中仅能利用天冬酰胺(Asn)、天冬氨酸(Asp)、谷氨酸(Glu)或谷氨酰胺(Gln)(图4-B).
图4-B为卡介苗分枝杆菌在HdB(pH5.
5)中的生长曲线;关于结核分枝杆菌在HdB(pH5.
5)中的生长曲线见文献[7].
图4分枝杆菌氨产生机制和抗酸示意图Fig.
4Demonstrationofammoniagenerationandgrowthofmycobacteriainacidicmedium.
A:Theconceptmodelofammoniagenerationandsecretionbymycobacteria.
IM:Innermembrane;OM:outermembrane;Asn(Asparagine);AnsA(Asparaginase),AnsB(Asparaginesynthetase);Asp(Aspartate);AspC(Aspartateaminotransferase);Glu(Glutamicacid);Glutamine(Gln);GlnA1/A2/A4(GlutaminesynthetaseA1/A2/A4);Amt(Ammoniatransporter);GlnB(PIIprotein).
B:GrowthofM.
bovisBCGinHdB(pH5.
5)mediumsupplementedwithAsn,Glu,Asp,Gln,Arg,orNitrate(NO-3)asthesolenitrogensource.
Curvesfromother15naturalaminoacidswereexcludedduetoinvisiblegrowth.
Doublingtime(d)foreachnitrogensourceisindicatedasshown.
3讨论在静止期的巨噬细胞中,结核分枝杆菌可以阻碍吞噬小体和溶酶体的融合.
但是,在γ-IFN等细胞因子的刺激下,吞噬小体可以加速和溶酶体融合,并释放各种因子试图"清除"入侵的结核分枝杆菌,包括:超氧离子、泛素肽、金属离子[11-12]、水解酶、质子流等[6].
但是结核分枝杆菌也在进化中形成了"反清除"机制.
其中,酸适应几乎是所有通过呼吸道和消化道感染的致病菌采取的"反清除"策略之一.
在酸性条件下,结核分枝杆菌内一些与破坏宿主溶酶体相关的基因表达会上调,包括:aprA/B/C系统(AcidandphagosomeregulatedA/B/C)[13]以及可以引起溶酶体膜裂解的ESAT-6(Earlysecretedantigen-6)[14]、Mg2+转运蛋白[6](MgtC)和膜蛋白Rv3671c等[15],同时分枝杆菌还产生碱性物质中和微环境中的酸性.
在中性培养基中,结核分枝杆菌和卡介苗分枝杆菌可以利用除了天冬酰胺、天冬氨酸、谷氨酰胺和谷氨酸之外的多种氨基酸(如:精氨酸、丝氨酸)和硝酸盐;但是在酸性培养基中只能利用天冬酰胺、天冬氨酸、谷氨酰胺和谷氨酸,并伴随溶液pH的升高.
这是因为分枝杆菌在精氨酸、丝氨酸和硝酸盐代谢中不能产生碱性物质,因此无法中和酸性环境(图4-B).
有趣的是我们仅在以天冬酰胺为唯一氮源的培养基中检测到了氨的存在.
对于以天冬氨酸(Asp)、谷氨酸(Glu)或谷氨酰胺(Gln)为唯一氮源的培养基,虽然我们发现当分枝杆菌生长后,培养液pH也升高,但是我们检测不到2741蔡潇浪等:天冬酰胺酶介导的分枝杆菌酸适应机制.
/微生物学报(2012)52(12)氨.
这说明当以天冬氨酸、谷氨酸或谷氨酰胺为唯一氮源时,分枝杆菌产生了另外一种不同于氨的碱性物质我们曾经利用质谱和核磁共振对培养液进行了分析,但都找不到在以天冬氨酸(Asp)、谷氨酸(Glu)或谷氨酰胺(Gln)为唯一氮源的条件下,足以引起pH升高的碱性物质(结果未列出).
那么,是不是在以天冬氨酸(Asp)、谷氨酸(Glu)或谷氨酰胺(Gln)为唯一氮源时,虽然不产生碱性物质,但是分枝杆菌过多的消耗了细胞外的H+而导致了pH升高呢或者说胞外的H+通过质子泵运送到胞内后,和胞内产生的NH3结合生成NH4+(图4A),胞内的NH4+来不及输送到细胞外,就被细胞利用产生其他氨基酸呢关于这一解释,目前尚缺乏直接的实验证据.
其实,结核分枝杆菌利用天冬酰胺作为氮源产生氨,早在50年前就有报道[16-17],但是当时基于分子生物学发展的局限和基因组信息的缺乏,研究人员只是发现了这种产氨现象,但对于天冬酰胺的代谢机理和氨的作用机制并没有进行深入的研究.
直到1980年,Gordon等[18]人在《Nature》杂志上发文表明,氨在结核分枝杆菌感染的巨噬细胞内可以阻止溶酶体和吞噬小体的融合,并指出分枝杆菌中的氨可能来自于氨基类物质的代谢.
后来越来越多的证据表明:结核分枝杆菌产生的氨是其抗酸生长和影响破坏巨噬细胞溶酶体和吞噬小体融合的关键因素[19],而且分枝杆菌中氨转运受到多基因调控[20].
近期,我们在研究中也发现结核分枝杆菌产生的氨可能通过OmpATb(Rv0899)分泌到细胞外[7],这一发现很快被国外同行认可,并拓展成Rv0899的结构在固氮细菌中普遍存在[21],并与氨的分泌有关.
通过比较基因组学发现,天冬酰胺酶广泛存在于多种细菌中(比如:大肠杆菌).
为何结核分枝杆菌利用天冬酰胺酶分解天冬酰胺,产生的氨能够分泌到细胞外,且能引起液体培养基中pH升高,而大肠杆菌等却没有发现这种现象可能的原因有:(1)结核分枝杆菌为慢性生长菌(复制一代需要约18-24h),体内物质合成速度较慢,但是天冬酰胺酶活性很高(图1-C),并能在短时间内产生大量的氨,为了避免氨的累积对细胞的损伤,因此多余的氨将被释放到细胞外.
而大肠杆菌等快速生长菌(复制一代需要30-40min或1-2h),体内代谢活动旺盛,产生的氨很快参与到细胞内氨基酸的合成代谢活动中,体内不存在氨的累积现象,因此分泌到细胞外的氨数量几乎为零.
(2)在酸性环境中,不同的细菌抗酸机制是不一样的.
比如:沙门氏菌通过质子泵F1F0ATPase维持细胞内的酸碱平衡[22];幽门螺杆菌通过尿素酶分解尿素产生的氨来中和消化道内的酸性环境[23];血链球菌(Streptococcussanguis)通过分解精氨酸产生氨[24].
而在本文中,分枝杆菌可以利用天冬酰胺产生氨.
因此,氨的产生是细菌抗酸生长的特性之一.
根据结核分枝杆菌特有的、而在其他革兰氏阳性菌中不具备的细胞双层膜结构[25],我们绘制了天冬酰胺介导的氨产生示意图(图4-A).
该示意图的依据如下:(1)一般来说,革兰氏阳性菌只有一层膜,不存在外膜和内膜之分.
但是,结核分枝杆菌是革兰氏阳性菌中的特例,具有类似于革兰氏阴性菌的内膜和外膜[25],因此该示意图为双层膜结构;(2)氨为小分子物质,可以穿过细胞的磷脂双层膜[26],因此氨在胞内和胞外均出现;(3)氨转运蛋白Amt为内膜蛋白,在三界(Kingdom)生物中都存在[27],因此在内膜位置体现了Amt/GlnB复合体;(4)我们在前期研究中发现,外膜蛋白OmpATb也参与了氨的转运[7];因此在外膜位置体现了OmpATb;(5)天冬酰胺的转运蛋白Rv2127和Rv0346c源自基因组注释,可能为内膜蛋白,因此天冬酰胺的转运体现了这两种蛋白.
至于是否还需要其它外膜蛋白协助尚不清楚,因此用""表示;(6)天冬酰胺(Asn)、天冬氨酸(Asp)、谷氨酸(Glu)、谷氨酰胺(Gln)在分枝杆菌细胞内存在互换循环依据来自于BioCyc数据库对结核分枝杆菌代谢途径的注释(http://www.
biocyc.
com/MTBRV/NEW-IMAGEtype=PATHWAY&object=ASPASN-PWY).
在该示意图中,天冬酰胺(Asn)通过膜蛋白被转运到细胞内,在天冬酰胺酶(AnsA)的作用下产生氨(NH3)和天冬氨酸(Asp).
但是将天冬酰胺酶基因敲除后,将卡介苗分枝杆菌培养18天后仍然能检测到氨的存在,这说明天冬酰胺还有产生氨的备用途径,或许通过草酰琥珀酸盐(2-oxosuccinamate)途3741XiaolangCaietal.
/ActaMicrobiologicaSinica(2012)52(12)径(图4-A).
结核分枝杆菌在酸性条件下可以利用的四种氨基酸:天冬酰胺(Asn)、天冬氨酸(Asp)、谷氨酸(Glu)或谷氨酰胺(Gln)在分枝杆菌细胞内存在互换循环.
在以天冬酰胺为唯一氮源时,多余的氨通过氨转运内膜蛋白Amt/GlnB复合体[28-29]和外膜蛋白OmpATb[7]等输送到分枝杆菌细胞外.
至于结核分枝杆菌中是否存在类似于耻垢分枝杆菌中的穿孔外膜蛋白(porin),该蛋白在不需要任何能量的条件下可以转运氨基酸、糖、无机盐等各种亲水物质[30],目前尚不清楚.
本研究通过天冬酰胺酶首次揭示了分枝杆菌的产氨机理,产生的氨可以将周围的酸性环境中和,这为今后进一步通过感染细胞生物学实验研究分枝杆菌在巨噬细胞内的抗酸和在溶酶体、吞噬小体内的定位和迁移机制奠定了基础.
参考文献[1]WHOreport2011globaltuberculosiscontrol.
2011:1-246.
[2]SchaibleUE,Sturgill-KoszyckiS,SchlesingerPH,RussellDG.
CytokineactivationleadstoacidificationandincreasesmaturationofMycobacteriumavium-containingphagosomesinmurinemacrophages.
JournalofImmunology,1998,160(3):1290-1296.
[3]SidebothamRL,BaronJH.
Hypothesis:Helicobacterpylori,urease,mucus,andgastriculcer.
Lancet,1990,335(8683):193-195.
[4]OsawaR,OkitsuT,MorozumiH,YamaiS.
Occurrenceofurease-positiveVibrioparahaemolyticusinKanagawa,Japan,withspecificreferencetopresenceofthermostabledirecthemolysin(TDH)andtheTDH-related-hemolysingenes.
AppliedandEnvironmentalMicrobiology,1996,62(2):725-727.
[5]ChenJ,ChengC,XiaY,ZhaoH,FangC,ShanY,WuB,FangW.
Lmo0036,anornithineandputrescinecarbamoyltransferaseinListeriamonocytogenes,participatesinargininedeiminaseandagmatinedeiminasepathwaysandmediatesacidtolerance.
Microbiology,2011,157(Pt11):3150-3161.
[6]VandalOH,NathanCF,EhrtS.
AcidresistanceinMycobacteriumtuberculosis.
JournalofBacteriology,2009,191(15):4714-4721.
[7]SongH,HuffJ,JanikK,WalterK,KellerC,EhlersS,BossmannSH,NiederweisM.
ExpressionoftheompATboperonacceleratesammoniasecretionandadaptationofMycobacteriumtuberculosistoacidicenvironments.
MolecularMicrobiology,2011,80(4):900-918.
[8]SongH,WolschendorfF,NiederweisM.
Constructionofunmarkeddeletionmutantsinmycobacteria.
InT.
Parish,andA.
Brown(Eds):Mycobacteriaprotocols.
HumanaPress,Ottawa,2008,279-295.
[9]StephanJ,StemmerV,NiederweisM.
ConsecutivegenedeletionsinMycobacteriumsmegmatisusingtheyeastFLPrecombinase.
Gene,2004,343:181-190.
[10]SmeuldersMJ,KeerJ,SpeightRA,WilliamsHD.
AdaptationofMycobacteriumsmegmatistostationaryphase.
JournalofBacteriology,1999,181(1):270-283.
[11]WolschendorfF,AckartD,ShresthaTB,Hascall-DoveL,NolanS,LamichhaneG,WangY,BossmannSH,BasarabaRJ,NiederweisM.
CopperresistanceisessentialforvirulenceofMycobacteriumtuberculosis.
ProceedingsoftheNationalAcademyofSciences,2011,108(4):1621-1626.
[12]BotellaH,PeyronP,LevillainF,PoinclouxR,PoquetY,BrandliI,WangC,TailleuxL,TilleulS,CharriereGM,WaddellSJ,FotiM,Lugo-VillarinoG,GaoQ,Maridonneau-PariniI,ButcherPD,CastagnoliPR,GicquelB,deChastellierC,NeyrollesO.
Mycobacterialp(1)-typeATPasesmediateresistancetozincpoisoninginhumanmacrophages.
CellHostMicrobe,2011,10(3):248-259.
[13]AbramovitchRB,RohdeKH,HsuFF,RussellDG.
aprABC:aMycobacteriumtuberculosiscomplex-specificlocusthatmodulatespH-drivenadaptationtothemacrophagephagosome.
MolecularMicrobiology,2011,80(3):678-694.
[14]RenshawPS,LightbodyKL,VeverkaV,MuskettFW,KellyG,FrenkielTA,GordonSV,HewinsonRG,BurkeB,NormanJ,WilliamsonRA,CarrMD.
StructureandfunctionofthecomplexformedbythetuberculosisvirulencefactorsCFP-10andESAT-6.
TheEMBOJournal,2005,24(14):2491-2498.
[15]VandalOH,PieriniLM,SchnappingerD,NathanCF,4741蔡潇浪等:天冬酰胺酶介导的分枝杆菌酸适应机制.
/微生物学报(2012)52(12)EhrtS.
AmembraneproteinpreservesintrabacterialpHinintraphagosomalMycobacteriumtuberculosis.
NatureMedicine,2008,14(8):849-854.
[16]LongER(1958):Utilizationofnitrogenforgrowth.
InE.
R.
Long(Ed.
):Thechemistryandchemotherapyoftuberculosis.
TheWilliams&WilkinsCompany,London,pp.
80-85.
[17]LyonRH,HallWH,Costas-MartinezC.
EffectofL-asparagineongrowthofMycobacteriumtuberculosisandonutilizationofotheraminoacids.
JournalofBacteriology,1974,117(1):151-156.
[18]GordonAH,HartPD,YoungMR.
Ammoniainhibitsphagosome-lysosomefusioninmacrophages.
Nature,1980,286(5768):79-80.
[19]HmamaZ,GabathulerR,JefferiesWA,deJongG,ReinerNE.
AttenuationofHLA-DRexpressionbymononuclearphagocytesinfectedwithMycobacteriumtuberculosisisrelatedtointracellularsequestrationofimmatureclassIIheterodimers.
JournalofImmunology,1998,161(9):4882-4893.
[20]AmonJ,BrauT,GrimrathA,HansslerE,HasseltK,HollerM,JessbergerN,OttL,SzokolJ,TitgemeyerF,BurkovskiA.
NitrogencontrolinMycobacteriumsmegmatis:nitrogen-dependentexpressionofammoniumtransportandassimilationproteinsdependsontheOmpR-typeregulatorGlnR.
JournalofBacteriology,2008,190(21):7108-7116.
[21]MarassiFM.
MycobacteriumtuberculosisRv0899definesafamilyofmembraneproteinswidespreadinnitrogen-fixingbacteria.
Proteins,2011,79(10):2946-2955.
[22]FosterJW.
Salmonellaacidshockproteinsarerequiredfortheadaptiveacidtoleranceresponse.
JournalofBacteriology,1991,173(21):6896-6902.
[23]SachsG,ScottD,WeeksD,MelchersKN.
TheimportanceofthesurfaceureaseofHelicobacterpylori:factorfictionTrendsinMicrobiology,2001,9(11):532-534.
[24]QuiveyRG,KuhnertWL,HahnK.
Geneticsofacidadaptationinoralstreptococci.
CriticalReviewsinOralBiology&Medicine,2001,12(4):301-314.
[25]HoffmannC,LeisA,NiederweisM,PlitzkoJM,EngelhardtH.
Disclosureofthemycobacterialoutermembrane:Cryo-electrontomographyandvitreoussectionsrevealthelipidbilayerstructure.
ProceedingsoftheNationalAcademyofSciences,2008,105(10):3963-3967.
[26]AntonenkoYN,PohlP,DenisovGA.
Permeationofammoniaacrossbilayerlipidmembranesstudiedbyammoniumionselectivemicroelectrodes.
BiophysicalJournal,1997,72(5):2187-2195.
[27]ZhengL,KostrewaD,BernecheS,WinklerFK,LiXD.
ThemechanismofammoniatransportbasedonthecrystalstructureofAmtBofEscherichiacoli.
ProceedingsoftheNationalAcademyofSciences,2004,101(49):17090-17095.
[28]AmonJ,TitgemeyerF,BurkovskiA.
Agenomicviewonnitrogenmetabolismandnitrogencontrolinmycobacteria.
JournalofMolecularMicrobiologyandBiotechnology,2009,17(1):20-29.
[29]GruswitzF,O'ConnellJ,3rd,StroudRM.
Inhibitorycomplexofthetransmembraneammoniachannel,AmtB,andthecytosolicregulatoryprotein,GlnK,at1.
96A.
ProceedingsoftheNationalAcademyofSciences,2007,104(1):42-47.
[30]SongH,NiederweisM.
UptakeofsulfatebutnotphosphatebyMycobacteriumtuberculosisisslowerthanthatforMycobacteriumsmegmatis.
JournalofBacteriology,2012,194(5):956-964.
5741XiaolangCaietal.
/ActaMicrobiologicaSinica(2012)52(12)AsparaginasemediatedacidadaptationofmycobacteriaXiaolangCai1#,BeibeiWu2#,YangFang1,HouhuiSong1*1CollegeofAnimalScienceandTechnology,ZhejiangAgriculture&ForestryUniversity,Lin'an311300,China2ZhejiangProvincialCenterforDiseaseControlandPrevention,Hangzhou310051,ChinaAbstract:[Objective]Mycobacteriumtuberculosiscansurviveinsidehostcellsforalongtime.
Toelucidatetheacidadaptationmechanismmediatedbytheasparagine(Asn)metabolicpathway,theactivityofasparaginase(AnsA)andgrowthofmycobacteriawerecharacterized.
[Methods]ThenonpathogenicM.
bovisBCGwasusedasamodelstraintocharacterizeAnsAfunction.
TherecombinantAnsAwasfurtherexpressedinE.
coli,purifiedbyCo2+chargedresin,andanalyzedbyenzymaticmethod.
M.
bovisBCGmutant(DansA)wasconstructedbyhomologousrecombination.
ThegrowthandammoniagenerationbyM.
bovisBCGwildtypeandmutantwereevaluatedinacidicmedium.
[Results]AmmoniawasdetectedinthepresenceofAnsAandAsn.
DeletionofansAsignificantlydelayedthegrowthofM.
bovisBCGfor10daysinacidicmedium.
AsnwasusedbyM.
bovisBCGtoproduceammonia,increasingpH.
[Conclusion]TheacidadaptationofM.
bovisBCGwasmediatedbyammonia,themetabolicproductofasparagine.
ThisprovidesnewcluetouncoverthesurvivalmechanismofM.
tuberculosisinsidetheacidicnicheenvironmentofhostmacrophage.
Keywords:M.
bovisBCG,asparagine,asparaginase,acidadaptation(本文责编:张晓丽)SupportedbytheNationalProgramsforHighTechnologyResearchandDevelopmentofChina(2012AA101602),bytheNationalNaturalScienceFoundationofChina(30800014)andbytheZhejiangAgriculture&ForestryUniversityTalentStartingProgram(2034020075)*Correspondingauthor.
Tel:+86-571-63741392;E-mail:songhh@zafu.
edu.
cn#Theseauthorscontributedequallytothiswork.
Received:5June2012/Revised:檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶檶5July2012科学出版社新书推介(2012年9、10月)中国微生物基因组研究作者:喻子牛,邵宗泽,孙明;ISBN:9787030357236;定价:190;开本:16;装帧:平装;页码:692;初版时间:2012-10-1内容简介:《中国微生物基因组研究》由我国从事微生物基因组研究的专家们结合自己的研究领域撰写的综述论文组成,反映了我国微生物基因组研究的过去、现在,并指出了未来尚需研究的方向.
共分为真细菌基因组(包括人畜病原真细菌,农用真细菌,环境真细菌,冶金、食品真细菌基因组)、古生菌基因组、真核微生物基因组、病毒基因组、微生物基因组研究方法五个部分.
订购方式1:网上购书淘宝商城科学出版社旗舰店:http://kxcbs.
tmall.
com/卓越亚马逊:http://www.
amazon.
cn/当当网:http://www.
dangdang.
com/京东图书:http://book.
360buy.
com/订购方式2:电话购书联系人:科学出版社贾海涛13501022258010-64017321订购方式3:邮件购书生物分社:lifescience@mail.
sciencep.
com;贾海涛:jiahaitao@mail.
sciencep.
com6741
- 分枝淘宝摇一摇怎么进入相关文档
- 投票站淘宝摇一摇怎么进入
- 收稿日期:2010-09-20摇摇摇摇修回日期:2010-10-29
- 阿里淘宝摇一摇怎么进入
- 知识点淘宝摇一摇怎么进入
- 您的淘宝摇一摇怎么进入
- 登录淘宝摇一摇怎么进入
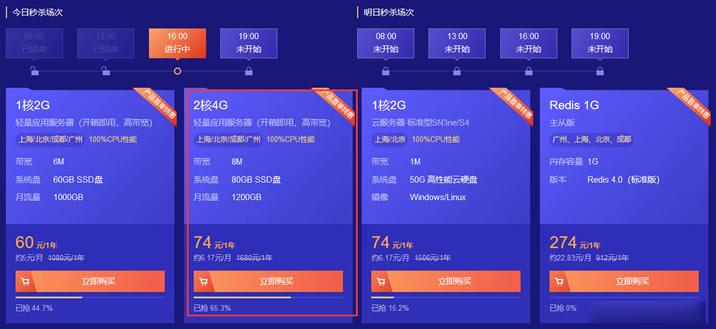
腾讯云轻量服务器两款低价年付套餐 2核4GB内存8M带宽 年74元
昨天,有在"阿里云秋季促销活动 轻量云服务器2G5M配置新购年60元"文章中记录到阿里云轻量服务器2GB内存、5M带宽一年60元的活动,当然这个也是国内机房的。我们很多人都清楚备案是需要接入的,如果我们在其他服务商的域名备案的,那是不能解析的。除非我们不是用来建站,而是用来云端的,是可以用的。这不看到其对手腾讯云也有推出两款轻量服务器活动。其中一款是4GB内存、8M带宽,这个比阿里云还要狠。这个真...
PacificRack 下架旧款方案 续费涨价 谨慎自动续费
前几天看到网友反馈到PacificRack商家关于处理问题的工单速度慢,于是也有后台提交个工单问问,没有得到答复导致工单自动停止,不清楚商家最近在调整什么。而且看到有网友反馈到,PacificRack 商家的之前年付低价套餐全部下架,而且如果到期续费的话账单中的产品价格会涨价不少。所以,如果我们有需要续费产品的话,谨慎选择。1、特价产品下架我们看到他们的所有原来发布的特价方案均已下架。如果我们已有...
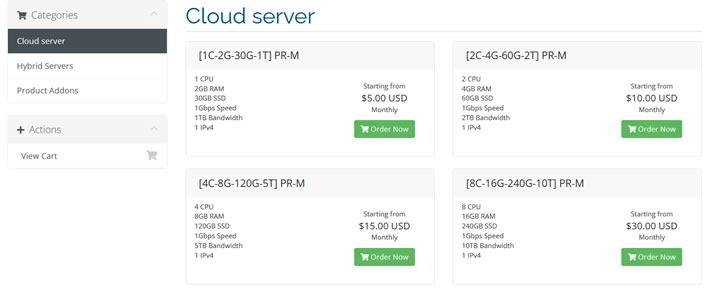
提速啦(24元/月)河南BGP云服务器活动 买一年送一年4核 4G 5M
提速啦的来历提速啦是 网站 本着“良心 便宜 稳定”的初衷 为小白用户避免被坑 由赣州王成璟网络科技有限公司旗下赣州提速啦网络科技有限公司运营 投资1000万人民币 在美国Cera 香港CTG 香港Cera 国内 杭州 宿迁 浙江 赣州 南昌 大连 辽宁 扬州 等地区建立数据中心 正规持有IDC ISP CDN 云牌照 公司。公司购买产品支持3天内退款 超过3天步退款政策。提速啦的市场定位提速啦主...

淘宝摇一摇怎么进入为你推荐
-
相机内存卡数据恢复怎样恢复相机存储卡数据cf蜗牛外挂蜗牛透视如何使用租车平台哪个好想租车,什么平台好苹果手机助手哪个好iphone有什么比较好用的软件!手机炒股软件哪个好什么手机炒股软件好用,你们都用哪个oppo和vivo哪个好Vivo和OPPO哪个好点啊?云盘哪个好云盘有哪些,哪个云盘好牡丹江教育云空间登录请问一下校园云空间的登录方式有哪些?q空间登录怎样从空间登录QQ号51个人空间登录为什么登陆51博客个人空间就不能登陆QQ