光敏剂ya
wx.qq.comyao 时间:2021-03-03 阅读:()
·综述·光动力灭菌研究进展王钰铖1,2顾瑛1*黄乃艳1摘要细菌引起的感染是临床上常见的问题,尤其是抗生素耐药菌的出现给医疗卫生工作带来了严峻考验.
光动力疗法是治疗肿瘤、血管性疾病的一种新的方法.
目前的研究表明光动力疗法可以有效杀伤致病菌,为治疗感染性疾病提供了一种新的思路.
本文为光动力灭菌影响因素、其作用位点方面研究进展的综述.
随着新型光敏剂的不断开发、光动力影响因素研究的深入、光动力治疗方法的不断成熟,光动力灭菌将具有广阔的应用前景.
关键词细菌;感染性疾病;光动力疗法中图分类号:R454.
2文献标识码:A文章编号:1003-9430(2012)02-0122-08基金项目:国家自然科学基金资助项目(81171633、60878055、61036014)作者单位:1.
解放军总医院激光医学科(北京市,100853)2.
南开大学医学院作者简介:王钰铖(1987~),女,湖北黄冈人,在读医学硕士,主要从事激光医学的基础研究和临床应用研究.
*通讯作者ProgressinResearchofAntimicrobialPhotodynamicTherapyWANGYu-cheng1,2,GUYing1*,HUANGNai-yan11.
DepartmentofLaserMedicine,ChinesePLAGeneralHospital,Beijing100853,China2.
SchoolofMedicine,Nan-kaiUniversityABSTRACTBacterialinfectionisacommonclinicalproblem.
Theemergenceofantibioticresistantbacteriaisaseverechallengetomedcialwork.
Photodynamictherapy(PDT)isanewmodalityforcancerandvasculardiseases.
RecentresearthshowedthatPDTcaneffective-lykillpathogens,thusprovidinganewideaforthetreatmentofinfectiousdiseases.
TheprogressinresearchofinfluencefactorsandtheroleofPDTisreviewedinthispaper.
Alongwiththedevelopmentofnewphotosensitiers,furtherresearchonthephotodynamicin-fluencefactors,thematureofPDT,PDTwillhaveabroadprospectinitsapplicution.
KeywordsBacteria;Infectivedisease;Photodynamictherapy背景感染性疾病在全球人口死亡原因中占重要比重.
随着抗生素的普遍应用及不断升级,致病菌感染并未得到完全控制.
相反,许多致病菌或条件致病菌在环境选择的压力下,通过变异发展出一套有效抵御多种抗生素杀伤的能力.
其中对三类及三类以上抗生素同时耐药的现象称之为多重耐药(multi-drugresistant,MDR).
由多重耐药菌引起的感染已·221·中国激光医学杂志2012年4月第21卷第2期ChinJLaserMedSurg,April2012,Vol21,No.
2经成为严重影响患者健康和医疗安全的严重问题.
近年来多重耐药菌的加速出现与临床上抗生素的不合理使用有关.
在抗生素滥用形成的选择性压力下,抗生素敏感株被淘汰,原来只占很少比例的耐药菌株被保留下来,并不断扩大,逐渐成为优势菌株.
而变异产生的耐药基因或质粒还可在菌体间通过接合、转导等方式传递,再次增加了耐药菌株产生的速度.
当感染的微生物对一线药物产生耐药性后,就必须使用更昂贵、心肾毒性更大的抗生素进行治疗,往往导致住院时间延长、医疗费用增加,给家庭及社会带来沉重的经济负担.
国外研究比较了46例感染耐药肠杆菌的患者及113例感染非耐药肠杆菌的患者,死亡率分别为46%和13%,平均住院时间分别是29.
5d和19d,每例患者医疗费用分别是$79323元和$40406元,差异显著[1].
没有有效的抗生素治疗或预防感染,器官移植、癌症化疗和大型手术等治疗的成功率也会大打折扣.
多重耐药菌引起的感染导致的高死亡率、高住院费用已经使医务工作者面临着严峻的考验.
2010年8月,英国医学期刊《柳叶刀》公布了一种携带"新德里金属蛋白酶-1(NDM-1)"基因的细菌,这种细菌对目前临床上常用的几乎所有抗生素都有极强的耐药性,被称为"超级细菌"[2].
目前临床上常用的抗感染药物和方法对此类感染的疗效都十分有限.
一旦出现具有社区感染能力的泛耐药菌感染,后果将十分严重,必然导致公共卫生事业面临危机.
对致病菌感染的传统治疗方法是抗生素治疗,但抗生素研发周期长达10年,而致病菌则可在短时间内产生耐药性,抗生素的研发速度远远赶不上细菌耐药特性产生的速度.
耐药菌的出现是临床需要不断面对的问题,因此有必要采用一种有效并且不易产生耐受性的方法来替代或者辅助传统的抗生素治疗.
光动力灭菌概述光动力疗法(photodynamictherapy,PDT)是目前国际上正在发展的一种新技术,已经成功应用于肿瘤的治疗,成为手术、放疗、化疗之外的第四种疗法.
其基本原理是光敏剂(photosensitizer,PS)在合适的光源照射下,从基态经寿命极短的单线态,系间穿越到三线态.
受光激发的三线态光敏剂可进行两种形式的反应:(1)经过氢原子或电子转移,直接同底物或溶剂反应,形成自由基,为Ⅰ型(TypeⅠ)反应;(2)能量转移到氧分子,形成单线态氧1O2,为Ⅱ型(TypeⅡ)反应.
通过Ⅰ型、Ⅱ型反应产生的以单线态氧为代表的一系列毒性活性产物可以与细胞或微生物的磷脂、核酸和蛋白质等生物大分子反应,破坏生物膜结构或其他功能单位,使细胞或微生物死亡,从而达到治疗效果.
光敏剂分子的结构特点使其更易聚集在生长旺盛的细胞中,因此肿瘤细胞是良好的作用靶点,同时微生物由于繁殖迅速,比正常体细胞对光敏剂亲和性更强,因此,PDT可选择性作用于感染的微生物,是一种有效的杀灭微生物的方法.
最早报道光动力作用的是1900年慕尼黑的医科大学生OscarRaab,他发现用吖啶作为光敏剂,光照下可杀死草履虫.
20世纪初期,人们陆续发现几种可以作为光敏剂的物质,如抗细菌的吖啶普鲁黄(acridinesproflavine)、吖啶黄(acriflavine)及对细菌和真菌有杀伤作用的三苯代甲烷(triphenylmeth-anes)、结晶紫(crystalviolet)、亮绿(brilliantgreen).
在第一次世界大战时期,PDT灭活微生物被用于战伤感染的治疗,挽救了许多生命.
但随着"抗生素时代"的来临,PDT在抗感染方面的研究并没有得到重视,相反在恶性疾病中的应用则取得了很大的突破.
在美国,以Photofrin为光敏药物的抗肿瘤PDT已于1996年获得FDA批准;在加拿大、法国、荷兰、德国、英国、日本等二十几个主要发达国家,PDT也先后取得合法地位.
研究证明PDT能缓解食管癌[3]、膀胱癌[4]等恶性肿瘤患者临床症状、延缓病情进展、延长生存期、提高生活质量.
抗生素耐药菌的大量出现,使光动力抗微生物化学疗法(pho-todynamicantimicrobialchemotherapy,PACT)或抗微生物光动力疗法(antimicrobialphotodynamicthera-py,aPDT)的应用重新受到越来越多研究人员的关注.
与传统的抗生素治疗相比,光动力灭菌有以下优势:(1)抗菌谱广,可作用于细菌、真菌、病毒、原虫等;(2)对耐药菌株也同样有效;(3)能够通过一定的PDT方案在对宿主组织没有损害的条件下,有效杀伤病原微生物;(4)多次治疗后不会产生对PDT耐受的情况;(5)无致畸性;(6)光源及光敏剂造价低廉;(7)可通过多种给药方式使光敏剂到达感染处;(8)光敏剂毒副作用低,对肝肾功能影响小;(9)对正常组织影响小,年老体弱的患者也可以接受治疗;(10)无需长期用药,不受患者依从性影响;(11)在缺乏血运的感染部位也可起效,可以用于抗生素无法治疗的坏死组织感染;(12)对微生物分泌的毒性因子同样有灭活作用.
PDT用于灭活微·321·中国激光医学杂志2012年4月第21卷第2期ChinJLaserMedSurg,April2012,Vol21,No.
2生物、治疗感染方面有极好的应用前景.
光动力灭菌的影响因素一、光敏剂因素1.
光敏剂离子特性的影响高效光敏剂是提高光动力效率的重要前提.
光敏剂分子须具有以下特点:能吸收可见光,激发到三线态,能有效地将电子或能量转移给其他分子.
一般来说,革兰氏阳性菌对阳离子、中性及阴离子光敏剂介导的光动力反应均敏感,革兰氏阴性菌比阳性菌更难杀灭,只有用阳离子光敏剂才能产生明显的PDT杀伤作用[5,6],这是因为革兰氏阳性菌细胞壁中穿插有脂蛋白、脂磷壁酸形成相对多孔的结构,对光敏剂屏障作用较弱,不同离子特性的光敏剂几乎都有一定的通透性.
而革兰氏阴性菌细胞壁在肽聚糖层外还有三层结构,由内向外依次为脂蛋白、脂质双层和脂多糖,三层共同构成外膜,外膜具有通透性屏障作用,能阻止多种大分子(包括光敏剂)进入.
阳离子型光敏剂通过"自促进吸收过程(self-promoteduptakepath-way)"渗透进入革兰氏阴性菌:细胞壁上有Mg2+、Ca2+等二价阳离子锚定在细胞壁外带负电荷的脂多糖(LPS)上,阳离子光敏剂置换这些二价阳离子,使细菌外膜的屏障功能减弱,允许更多的光敏剂通过或结合于细胞壁,进一步增加细胞屏障的通透性引起更多光敏剂的吸收[7].
因此阳离子光敏剂能通过这种链式反应过程与革兰氏阴性菌结合或渗透进入外膜,携带正电荷的量与光敏剂对革兰氏阴性菌的光动力效应密切相关.
阳离子型的卟啉类光敏剂以脂质体形式存在时,对革兰氏阴性菌的光动力效应减弱[8].
在中性或碱性环境下,细菌表面带有负电荷,即使是革兰氏阳性菌,阳离子光敏剂的光动力杀伤作用也更有效,因为它与细菌有更强的静电吸引力.
但与针对革兰氏阴性菌不同,革兰氏阳性菌的光动力杀伤对电荷量的要求相对较低.
带有较少正电荷量的较小光敏剂分子与带正电荷量多的大分子光敏剂相比,前者能达到更好的PACT效果[9,10].
这是因为革兰氏阳性菌的细胞壁多孔结构类似于"分子筛",分子量小的光敏剂更易透过细胞壁.
几种不同的合成菌绿素(bacteriochorin)作为光敏剂时,带正电荷最多的光敏剂对革兰氏阴性菌PACT效应最为明显;而对革兰氏阳性菌,正2价光敏剂PACT效应优于正4价、正6价及电中性光敏剂.
研究者认为,光敏剂要结合于细菌表面的阴离子基团或渗透入细胞,需携带合适的电荷,对革兰氏阴性菌,正电荷多有利于光敏剂与LPS结合并增加细胞壁通透性;而对于革兰氏阳性菌,携带正电荷太少,光敏剂不足以结合于带负电的细胞壁,带正电荷太多,光敏剂与细胞壁结合太紧密,也不利于光敏剂渗透进入细胞壁[5].
2.
光敏剂溶解性的影响光敏剂的PACT效应还与光敏剂的溶解性有关.
Huang等[11]在设计的几种碳簇分子(fullerenes)中归纳出光敏剂携带的正电荷数本身就与脂水分配系数(LogP)有关,他们强调正电荷数及水溶性对光敏剂光动力灭菌效应的重要性.
还有研究认为,正电荷数越多,光敏剂与荷负电的细胞壁之间的静电引力越强,光敏剂与细菌细胞壁的结合越多;而脂溶性越强,光敏剂越容易穿透细菌结构中的脂质层,正电荷数多及脂溶性强协同作用可增强光敏剂的脂水双溶性,进而增加它们对细菌的亲和力[12],增加对细菌的光动力杀伤效应.
Alves等[13]比较了7种不同电荷量、不同电荷分布的阳离子型的卟啉类衍生物的PACT活性.
在PDT组中,7种卟啉类衍生物对革兰氏阳性菌粪肠球菌(E.
faecalis)都有完全的杀伤;而对革兰氏阴性菌大肠杆菌(E.
coli),仅3价(Tri-Py+-Me-PF、Tri-Py+-Me-CO2Me)及4价(Tetra-Py+-Me)阳离子光敏剂在最高浓度5.
0μM,光剂量为21.
6~64.
8J/cm2时细菌杀伤完全.
随着正电荷量减少,PACT对革兰氏阴性菌的杀伤作用依次减弱.
具有最强的PACT效应的是其中一种3价阳离子光敏剂Tri-Py+-Me-PF.
这种光敏剂虽然电荷数不是最大的,但它具有不对称的正电荷分布,因而与其他几种分子相比有最强的脂水双溶性(LogPB/W=-0.
17).
他们认为正电荷数及脂水双溶性共同决定了光敏剂的光动力灭菌效能.
这与Kessel等[14]的研究一致.
3.
光敏剂浓度及孵育时间的影响一般认为,光动力对细菌的杀伤作用是与光敏剂浓度、光剂量呈正相关.
但一些研究则认为,光敏剂浓度过高时,有一部分光敏剂未与细菌结合,不仅不能产生有效的光动力杀伤作用,反而会发生光遮蔽效应,影响杀菌效果[15].
调整治疗的光剂量时,也必须考虑到过高的激光功率密度和过长的光照时间可造成机体正常组织的非特异损伤.
光敏剂给药-光照间隔时间(PS-illuminationinterval)也是光动力方案的重要内容.
Schastak等[16]研究了PDT对四种细菌的杀伤效果:在相同光剂量下,提高光敏剂四氢卟啉四甲苯磺酸酯(tetrahydroporphyrintetratosylat,THPTS)浓度·421·中国激光医学杂志2012年4月第21卷第2期ChinJLaserMedSurg,April2012,Vol21,No.
2能增加杀伤效果;对甲氧西林敏感金黄色葡萄球菌(methicillin-susceptibleStaphylococcusaureus,MSSA),给药-光照间隔30min,即可达到理想的杀伤效果,增加间隔时间(90、180min),细菌杀伤效果不变;对耐甲氧西林金黄色葡萄球菌(methicillin-re-sistantStaphylococcusaureus,MRSA),给药-光照间隔为30min可达最大效果,但随着时间延长,效应减弱,这可能是由MRSA对光敏剂的代谢所致;对大肠杆菌和铜绿假单胞菌(P.
Aeruginosa),孵育时间为90min时才能达到最大杀伤效果.
Cassidy等[17]认为革兰氏阳性菌和革兰氏阴性菌的最佳给药光照间隔有所不同,对金黄色葡萄球菌,30min是最佳间隔时间;对铜绿假单胞菌最佳间隔时间是30s,孵育时间延长,光动力杀伤作用并不能提高.
他们解释,一些光敏剂是多药外排泵底物,因此延长光敏剂与细菌的孵育时间,并不能促进光敏剂与细菌结合或渗透入细菌体内,因而不能增加光动力杀菌效应.
二、细菌自身因素1.
细菌细胞壁通透性的影响光动力灭菌效果的一个有效途径是增加细胞屏障对光敏剂的通透性,非阳离子光敏剂与增加细菌屏障通透性的物质(如EDTA[18]、多粘菌素B[19])联合使用能提高对革兰氏阴性菌的光动力杀菌效应.
Yujie等[20]研究证明用CaCl2、MgCl2预处理会显著提高竹红菌甲素(HA)介导的PACT效应,甚至使对HA介导的光动力作用不敏感的E.
coli存活率降到5%以下.
他们认为CaCl2、MgCl2等物质能增加革兰氏阴性菌外膜通透性,使光敏剂分子或活性氧(reactiveoxygenspecies,ROS)定位于内膜或渗透进入胞质内,对细菌产生杀伤.
带正电荷的多肽与带负电的光敏剂二氢卟吩e6(chlorine6,Ce6)混合,能显著增加Ce6的光动力杀菌效应[6],也证明增加细胞屏障的通透性有利于光动力杀伤细菌.
2.
细菌生长状态的影响细菌根据生长状态可分为浮游(planktonic)状态和生物膜(biofilm)状态,细菌的生物膜较单个粘附的或混悬的细菌更易于抵抗免疫细胞、免疫分子及药物的攻击,并可克服液态流的冲击而持续生存,还可通过接合机制快速传递耐药基因,效率高于单个悬浮菌的一万倍,许多生物医学植入物,如中央静脉插管、导尿管、人工心脏瓣膜、关节替代物等被细菌粘附并形成生物膜,是引起慢性感染的重要原因,也是医源性感染微生物耐药性大大高于非医源性感染微生物的重要原因.
Donnelly等[15]观察了两种光敏剂介导的PDT对MRSA浮游菌及生物膜的杀伤效应:亚甲基蓝(methyleneblue,MB)引起的光动力效应对不同状态的MRSA有显著差异,浮游状态生长的细菌与细菌生物膜相比,对相同的PDT方案(10μg/ml,100J/cm2)更加敏感(前者细菌杀伤99.
99%,后者为88.
19%);meso-四(N-甲基-4-吡啶基)卟啉(me-so-tetra(N-methyl-4-pyridyl)porphinetetratosylate,TMP)引起的光动力效应对两种状态的MRSA没有明显差异(细菌杀伤均>99.
7%).
Street等[21]研究了牙菌斑中三种常见细菌牙龈类杆菌(P.
gingivalis)、核梭杆菌(F.
nucleatum)、伴放线放线杆菌(A.
actinomycetemcomitans)在不同状态时对PDT的敏感性,他们以MB为光敏剂,光剂量为9.
4J/cm2(670nm)时,引起浮游状态的细菌与对照组相比分别减少了(6.
8±0.
7)、(5.
2±0.
6)、(1.
9±0.
6)log10,生物膜状态的细菌与对照组相比分别减少(4.
5±1.
2)、(3.
4±1.
1)、(4.
9±1.
4)log10.
Pagonis等[22]以体外浮游状态及牙髓腔中生物膜状态的E.
faecalis为模型,发现两种状态的细菌对MB介导的PDT敏感性类似.
由于细菌生长、代谢速度的差异,不同生长期的细菌对PACT的敏感性也可能存在差异,处于对数生长期与处于平台期的细菌相比,前者对PACT更加敏感[17].
细菌密度较低时PACT引起的细菌数降低更显著[23].
三、环境因素1.
血清的影响光动力杀菌效应还受到环境中多种复杂因素的影响.
在Donnelly等[15]的研究中,MB在血清存在的条件下,光动力杀菌效应仅为不含血清时的23%,并且增加光剂量不能增加其光动力效应.
而TMP的PDT效应则不受血清的明显影响.
他们认为,MB介导的光动力效应受血清的影响可能是由于MB与血清成分结合,从而阻碍了MB与菌体的作用,这与Nitzan等[24]的研究一致;而TMP介导的光动力效应不受血清影响,是由于TMP的脂溶性及电荷分布有别于MB,与血清成分结合较少,因此血清对TMP介导的PACT效应影响较小.
Schastak等[16]的研究也表明,10%血清能明显降低PDT的细菌杀伤效应,尤其是铜绿假单胞菌在血清存在下对高浓度光敏剂介导的PDT几乎完全抵抗.
他们认为,血清蛋白可能与细菌细胞壁上的脂多糖环境(糖基化状态、电荷等)相互作用,改变细菌渗透性,降低光敏剂与细菌的亲和力.
调整光敏剂浓度及光敏剂给药-光照间隔时间有可能抵消·521·中国激光医学杂志2012年4月第21卷第2期ChinJLaserMedSurg,April2012,Vol21,No.
2血清对PACT效应的负向影响.
2.
氧浓度的影响光动力反应中,Ⅰ型反应无需氧环境,而Ⅱ型反应在有氧时才能发生.
在Yujie等[20]的研究中,用N2代替空气模拟无氧环境,发现缺氧使灭菌效应减弱.
Feuerstein等[25]实验证明,在无氧条件下,PDT对P.
gingivalis、F.
nucleatum的治疗效果与有氧条件下比较明显减弱.
Burns等[26]则认为无氧条件对变异链球菌的PDT效果无明显影响.
对缺氧条件的敏感程度不同,可由光动力过程中Ⅰ、Ⅱ型反应比例不同来解释,这一比例受光敏剂、底物、氧浓度以及光敏剂与底物结合程度的影响.
Street等[21]在PDT组用单线态氧清除剂L-色氨酸预处理,明显降低光动力作用对细菌的杀伤作用,证明单线态氧是PDT杀伤细菌的重要参与者.
HA介导的光动力反应中,同时清除光动力Ⅰ、Ⅱ型反应产物使细菌生存率获得最大幅度的提高,证明Ⅰ、Ⅱ型反应是同时存在、共同产生活性产物并发挥灭菌作用的[20].
Hamblin等[9]认为PDT对革兰氏阴性菌的杀伤过程中Ⅰ型反应产物起主要作用.
PACT的选择性PACT用于体内抗感染的前提是对机体正常组织无害,即选择性杀伤细菌.
光动力杀伤效应的选择性主要基于以下原理:一方面,宿主的正常组织细胞只能通过"内吞"的方式缓慢吸收光敏剂,而光敏剂被微生物吸收或与之结合是相对较快的过程[6];另一方面,光动力作用产生的单线态氧扩散范围约为100~200nm,由于真核细胞体积比原核细胞大2000倍,对微生物细胞,单线态氧能扩散到细胞内重要的结构产生致命损伤;而对于宿主细胞,由于自由基扩散距离的限制,无法对更敏感的胞内结构产生致命损害[6].
若光敏剂给药-光照间隔时间超过一定范围,则光敏剂可以缓慢"内吞"进入体细胞内,活性物质定位于细胞内重要结构,可造成非特异组织的损伤.
选择合适的光敏剂给药-光照间隔时间,可以提高光动力灭活微生物效果,并尽可能减少对机体正常组织的副作用.
有研究认为,细菌在与光敏剂孵育较短时间内(10~30min),PDT对细菌杀伤作用强,而对机体正常组织影响小[27,28].
光敏剂的种类、性质对细胞杀伤的选择性也有影响.
将带电情况不同的合成菌绿素作为光敏剂与细菌或Hela细胞分别孵育30min后光照发现,阳离子光敏剂对细菌的光动力杀伤效应为对Hela细胞杀伤的50倍以上,而中性光敏剂的选择性较差[5].
研究者认为,Hela细胞为真核结构,与原核细胞对光敏剂的要求有所不同,对中性光敏剂介导的光动力杀伤更敏感.
多聚赖氨酸共轭吩(polylysine-chlorin(e6)conjugate,pL-Ce6)及Ce6单体与细菌、上皮细胞系HCPC-1分别孵育1min后,细菌的对带正电荷的pL-Ce6的吸收是HCPC-1的30~100倍,阳离子型的pL-Ce6介导的光动力杀伤效应有很好的选择性[6].
PACT作用位点一般认为,光敏剂与微生物的结合主要有三种方式:(1)光敏剂紧密结合于微生物体或进入微生物体内[29];(2)光敏剂与微生物体松散可逆性结合[20];(3)未结合于微生物体[30].
细菌与光敏剂的结合方式依赖于光敏剂分子本身的化学性质及细菌种类[23].
Dahi等[31]用玫瑰红染料作光敏剂,以沙门氏菌为靶生物,用荧光反应观察玫瑰红在细菌上的分布,发现其主要在膜系统上,尤其在细胞壁上,而非在细胞体内.
Pagonis等[22]将含光敏剂MB的纳米颗粒和细菌共同孵育10min,在扫描电镜下观察纳米颗粒的形态及聚集部位,结果发现MB纳米颗粒大量聚集在细胞壁上,他们认为光动力作用对细菌的杀伤起始于细胞壁.
PACT可以破坏微生物质膜,引起细胞内容物渗漏[9],或使细胞膜上的转运系统和酶失活[32],一旦破坏细菌屏障结构,光敏剂进入菌体内,PACT产生的自由基则对多种生物分子如DNA、蛋白、脂质产生非特异性损伤.
Choi等[33]研究了MB在光照下对幽门螺杆菌的光动力反应,他们对处理后各组细菌DNA进行琼脂糖凝胶电泳,发现光动力组中DNA电泳条带弥散不清;定量检测各组中DNA氧化产物8-OHdG,发现PDT组中随着光照时间延长,该氧化产物的含量增加2~9倍(15min>10min>5min>0min).
除细菌本身的侵袭力,细菌产生、释放的毒素因子也是对宿主的严重威胁.
用抗生素治疗感染往往只能杀灭细菌本身,而不能灭活内、外毒素因子.
光动力治疗不仅能有效杀伤致病菌,还能灭活细菌毒素因子.
Tubby等[34]研究了光动力灭活葡萄球菌释放的几种毒素因子的效果,发现V8蛋白酶、α溶血素、神经鞘磷脂酶活性受到抑制,并且这种抑制效应与光剂量有依赖性.
Komerik等[35]也证明了甲苯胺蓝(toluidineblue,TBO)与红光联合作用可以有效灭活大肠杆菌及铜绿假单胞菌释放的毒素因子.
·621·中国激光医学杂志2012年4月第21卷第2期ChinJLaserMedSurg,April2012,Vol21,No.
2细菌对PDT的耐受性DNA不是光动力杀伤细菌的主要位点[36],尽管细菌有DNA损伤修复功能,细菌对PDT不易出现耐受性[37].
Winckler等[38]指出,细菌的细胞壁和细胞膜是PACT作用的主要靶点,光敏剂无需进入细菌体内,而只要与细菌的膜系统结合,在合适的光照下即可产生严重的细胞结构破坏.
细菌无法通过减少光敏剂吸收、增加光敏剂的代谢以及增加光敏剂的主动外排来实现对光动力的耐受性.
Tavares等[39]以5.
0μM的Tri-Py+-Me-PF为光敏剂,用功率密度为40w/cm2的白光照射270min,使V.
fischeri数量减少5.
1log10、E.
coli数量减少6.
4log10,继续培养后,未见细菌生长,证明光动力作用对细菌的杀伤是完全的和不可逆的.
他们还发现重复多次的PDT治疗不会诱导细菌对PDT耐受性的出现.
Pedigo等[40]也证明经过多次重复的PDT治疗,MR-SA、MSSA及E.
coli对PDT的敏感性没有下降.
Cassidy等[17]则研究了亚致死剂量的PDT(使细菌数量仅减少0.
5~1.
0log10的方案)能否影响金黄色葡萄球菌及铜绿假单胞菌对抗生素及致死剂量的PDT方案(使细菌数减少2log10的方案)的敏感性.
结果表明,与对照组相比,光动力处理并不降低两种细菌对抗生素的敏感性.
这一发现提示了光动力辅助传统抗生素用于抗感染治疗的可能性.
部分菌株对TMP或MB介导的光动力反应敏感性有不同程度的下降,但只有金黄色葡萄球菌的某一菌株对MB介导的光动力杀伤效应敏感性降低明显.
他们认为对光动力的耐受性不易产生是因为ROS仅在光照时产生,不足以诱导菌体产生抗氧化酶,如超氧化物歧化酶(superoxidedismutase,SOD);而部分菌株产生了一定的耐受性则可能是由于亚致死剂量的光动力方案上调了多药外排泵或抗氧化酶的表达,这种现象是因使用的光敏剂种类及菌株而异的.
Kim等[41]最近的研究表明MB介导的光动力反应引起大肠杆菌内主要的抗氧化酶表达上调及oxyR基因过表达,从而对MB-PDT引起的细菌杀伤有保护作用.
Nakonieczna等[42]发现对PDT的敏感性依菌株而异,只有对PDT敏感的菌株在光动力处理后才能观察到SOD的表达上调,暗示抗氧化因子的产生可能不是影响光动力敏感性的直接因素.
PACT在体研究及前景光动力治疗过程包括两个步骤:(1)光敏剂给药;(2)用合适的光源对病变组织或微生物感染部位进行照射.
肿瘤的光动力治疗通常用静脉给药方式,光敏剂随着血液循环到全身,并富集到代谢旺盛的肿瘤组织内,进而发生一系列的光化学反应,近年来也有一些局部给药和口服给药的报道.
而在微生物的PDT灭活过程中,如果也采用静脉给药,则到达局部的微生物时,光敏剂浓度已经很小,因此光敏剂主要采用局部给药的方式,如滴注、局部注射、气溶胶等方式.
Donnelly等[15]使用包含光敏剂MB或TMP的聚乙烯凝胶敷贴于局部,发现光敏剂能缓慢释放到组织中,并且释放速度与组织的温度正相关,这种凝胶具有一定的硬度,形状可塑,硬度和形态不受血清和渗出物的影响,因此可根据体表创伤的形状、大小局部应用,光敏剂释放达一定浓度后可去掉凝胶聚合物,进行光动力治疗,这是一种新的、有前景的光敏剂局部给药方式.
由于宿主细胞对光敏剂的吸附、对光的遮蔽以及对自由基的清除等原因,目前光动力灭菌在体内模型中的效果较体外PACT差[43],但一些动物实验仍预示了光动力抗感染在体内应用的前景.
Ragas等[44]用4种吩噻嗪类光敏剂对多重耐药的鲍曼不动杆菌进行体外的灭菌实验和在体的小鼠感染模型实验,结果表明4种光敏剂都能有效杀灭鲍曼不动杆菌,并且小鼠感染模型中的细菌没有出现再感染的情况.
Dai等[45]用酞青类光敏剂-PDT治疗大鼠皮肤MRSA感染的模型,观察到伤口愈合比对照组提前8.
6d.
Zolfaghari等[43]在小鼠体表伤及切割伤模型中验证了MB介导的光动力杀菌作用,在光动力处理后,从伤口中分离到的MRSA明显减少.
组织病理学显示伤口周围组织的表皮完整,未出现广泛坏死.
PDT后24h组织病理学检查结果也显示创伤部位没有扩大.
最近一些研究也报道了光动力灭菌治疗牙周炎的成功病例[46].
受光源穿透深度及辐照范围的限制,光动力对致病菌的杀伤主要用于治疗局部感染,如皮肤、软组织的感染.
随着光纤及内镜技术的发展,PACT也可用于呼吸道、消化道、泌尿道等腔道内感染的治疗.
随着新型光敏剂的不断开发、光动力影响因素研究的深入、光动力治疗方法的不断成熟,PACT辅助甚至在一些感染性疾病中取代抗生素治疗将成为可能,这将彻底改变传统的抗感染理念,缓解正日趋面临的抗生素耐药危机,必将翻开人类与致病菌斗争史上重要的一页.
·721·中国激光医学杂志2012年4月第21卷第2期ChinJLaserMedSurg,April2012,Vol21,No.
2参考文献[1]CosgroveSE,KayeKS,EliopoulousGM,etal.
Healthandeconomicoutcomesoftheemergenceofthird-generationcephalosporinresistanceinEnterobacterspecies[J].
ArchInternMed,2002,162:185-190.
[2]KumarasamyKK,TolemanMA,WalshTR,etal.
Emer-genceofanewantibioticresistancemechanisminIndia,Pakistan,andtheUK:amolecular,biological,andepide-miologicalstudy[J].
LancetInfectDis,2010,10:597-602.
[3]LuketichJD,ChristieNA,BuenaventuraPO,etal.
Endo-scopicphotodynamictherapyforobstructingesophagealcancer:77casesovera2yearperiod[J].
SurgEndosc,2000,14:653-657.
[4]WaltherMCM.
Theroleofphotodynamictherapyinthetreatmentofrecurrentsuperficialbladdercancer[J].
Uro-logicClinicsofNorthAmerica,2000,27:163-170.
[5]HuangL,HuangYY,MrozP,etal.
Stablesyntheticcat-ionicbacteriochlorinsasselectiveantimicrobialphotosensi-tizers[J].
AntimicrobAgentsChemother,2010,54:3834-3841.
[6]SoukosNS,Ximenez-FyvieLA,HamblinMR,etal.
Targe-tedantimicrobialphotochemotherapy[J].
AntimicrobA-gentsChemother,1998,42:2595-2601.
[7]GeorgeS,HamblinMR,KishenA.
Uptakepathwaysofan-ionicandcationicphotosensitizersintobacteria[J].
Photo-chemPhotobiolSci,2009,8:788-795.
[8]MerchatM,SpikesJD,BertoloniG,etal.
Studiesonthemechanismofbacteriaphotosensitizationbymeso-substitu-tedcationicporphyrins[J].
JPhotochemPhotobiolB,1996,35:149-157.
[9]HamblinMR,O'DonnellDA,MurthyN,etal.
Polycationicphotosensitizerconjugates:effectsofchainlengthandgramclassificationonthephotodynamicinactivationofbacteria[J].
JAntimicrobChemother,2002,49:941-951.
[10]TegosGP,AnbeM,YangC,etal.
Protease-stablepolyca-tionicphotosensitizerconjugatesbetweenpolyethylenei-mineandchlorin(e6)forbroad-spectrumantimicrobialphotoinactivation[J].
AntimicrobAgentsChemother,2006,50:1402-1410.
[11]HuangL,TerakawaM,ZhiyentayevT,etal.
Innovativecationicfullerenesasbroadspectrumlightactivatedanti-microbials[J].
Nanomedicine,2010,6:442-452.
[12]LazzeriD,RoveraM,PascualL,etal.
Photodynamicstud-iesandphotoinactivationofEscherichiacoliusingmeso-substitutedcationicporphyrinderivativeswithasymmetricchargedistribution[J].
PhotochemPhotobiol,2004,80:286-293.
[13]AlvesE,CostaL,CarvalhoCM,etal.
ChargeeffectonthephotoinactivationofGramnegativeandGram-positivebac-teriabycationicmesosubstitutedporphyrins[J].
BMCMi-crobiol,2009,9:70.
[14]KesselD,LuguyaR,VicenteMG.
Localizationandphoto-dynamicefficacyoftwocationicporphyrinsvaryinginchargedistributions[J].
PhotochemPhotobiol,2003,78:431-435.
[15]DonnellyRF,CassidyCM,LoughlinRG,etal.
DeliveryofMethyleneBlueandmeso-tetra(N-methyl-4-pyridyl)porphinetetratosylatefromcross-linkedpoly(vinylalco-hol)hydrogels:apotentialmeansofphotodynamicthera-pyofinfectedwounds[J].
JPhotochemPhotobiolB,2009,96:223-231.
[16]SchastakS,ZiganshynaS,GitterB,etal.
Efficientphoto-dynamictherapyagainstgram-positiveandgram-negativebacteriausingTHPTS,acationicphotosensitizerexcitedbyinfraredwavelength[J].
PLoSOne,2010,5:e11674.
[17]CassidyCM,DonnellyRF,TunneyMM.
Effectofsub-le-thalchallengewithphotodynamicantimicrobialchemo-therapy(PACT)ontheantibioticsusceptibilityofclinicalbacterialisolates[J].
JPhotochemPhotobiolB,2010,99:62-66.
[18]BertoloniG,RossiF,ValdugaG,etal.
Photosensitizingactivityofwater-andlipid-solublephthalocyaninesonEscherichiacoli[J].
FemsMicrobiolLett,1990,59:149-155.
[19]NitzanY,GuttermanM,MalikZ,etal.
Inactivationofgram-negativebacteriabyphotosensitizedporphyrins[J].
PhotochemPhotobiol,1992,55:89-96.
[20]YujieSu,JunSun,ShengqiRao,etal.
Photodynamicanti-microbialactivityofhypocrellinA[J].
JPhotochemPho-tobiolB,2011,103:29-34.
[21]StreetCN,PedigoLA,LoebelNG.
Energydoseparametersaffectantimicrobialphotodynamictherapymediatederadi-cationofperiopathogenicbiofilmandplanktoniccultures[J].
PhotomedLaserSurg,2010,28:S61-66.
[22]PagonisTC,ChenJ,FontanaCR,etal.
Nanoparticle-basedendodonticantimicrobialphotodynamictherapy[J].
JEndod,2010,36:322-328.
[23]DemidovaTN,HamblinMR.
Effectofcell-photosensitizerbindingandcelldensityonmicrobialphotoinactivation[J].
AntimicrobAgentsChemother,2005,49:2329-2335.
[24]NitzanY,Balzam-SudakevitzA,AshkenaziH.
Eradica-tionofAcinetobacterbaumanniibyphotosensitizedagentsinvitro[J].
JPhotochemPhotobiolB,1998,42:211-218.
·821·中国激光医学杂志2012年4月第21卷第2期ChinJLaserMedSurg,April2012,Vol21,No.
2[25]FeuersteinO,GinsburgI,DayanE,etal.
MechanismofvisiblelightphototoxicityonPorphyromonasgingivalisandFusobacteriumnucleatum[J].
PhotochemPhotobiol,2005,81:1186-1189.
[26]BurnsT,WilsonM,PearsonGJ.
MechanismofkillingofStreptococcusmutansbylight-activateddrugs[J].
SPIE,1996,2625:288-297.
[27]ZeinaB,GreenmanJ,CorryD,etal.
Cytotoxiceffectsofantimicrobialphotodynamictherapyonkeratinocytesinvitro[J].
BrJDermatol,2002,146:568-573.
[28]SoukosNS,WilsonM,BurnsT,etal.
Photodynamiceffectsoftoluidineblueonhumanoralkeratinocytesandfibro-blastsandStreptococcussanguisevaluatedinvitro[J].
La-sersSurgMed,1996,18:253-259.
[29]MinnockA,VernonDI,SchofieldJ,etal.
Photoinactiva-tionofbacteria.
Useofacationicwater-solublezincphthalocyaninetophotoinactivatebothgram-negativeandgram-positivebacteria[J].
JPhotochemPhotobiolB,1996,32:159-164.
[30]DahlTA,MiddenWR,HartmanPE.
Comparisonofkillingofgram-negativeandgram-positivebacteriabypuresin-gletoxygen[J].
JBacteriol,1989,171:2188-2194.
[31]DahlTA,Valdes-AguileraO,MiddenWR,etal.
Partitionofrosebengalanionfromaqueousmediumintoalipophil-icenvironmentinthecellenvelopeofSalmonellatyphi-murium:implicationsforcell-typetargetinginphotody-namictherapy[J].
JPhotochemPhotobiolB,1989,4:171-184.
[32]KomagoeK,KatoH,InoueT,etal.
Continuousrealtimemonitoringofcationicporphyrin-inducedphotodynamicin-activationofbacterialmembranefunctionsusingelectro-chemicalsensors[J].
PhotochemPhotobiolSci,2011,10:1181-1188.
[33]ChoiSS,LeeHK,ChaeHS.
Invitrophotodynamicantimi-crobialactivityofmethyleneblueandendoscopicwhitelightagainstHelicobacterpylori26695[J].
JPhotochemPhotobiolB,2010,101:206-209.
[34]TubbyS,WilsonM,NairSP.
Inactivationofstaphylococ-calvirulencefactorsusingalight-activatedantimicrobialagent[J].
BMCMicrobiol,2009,9:211.
[35]KomerikN,WilsonM,PooleS.
Theeffectofphotodynamicactionontwovirulencefactorsofgram-negativebacteria[J].
PhotochemPhotobiol,2000,72:676-680.
[36]MenezesS,CapellaMA,CaldasLR.
Photodynamicactionofmethyleneblue:repairandmutationinEscherichiacoli[J].
JPhotochemPhotobiolB,1990,5:505-517.
[37]SchaferM,SchmitzC,HorneckG.
HighsensitivityofDei-nococcusradioduranstophotodynamically-producedsin-gletoxygen[J].
IntJRadiatBiol,1998,74:249-253.
[38]WincklerKD.
Specialsection:focusonantimicrobialpho-todynamictherapy(PDT)[J].
JPhotochemPhotobiolB,2007,86:43-44.
[39]TavaresA,CarvalhoCM,FaustinoMA,etal.
Antimicrobi-alphotodynamictherapy:studyofbacterialrecoveryvia-bilityandpotentialdevelopmentofresistanceaftertreat-ment[J].
MarDrugs,2010,8:91-105.
[40]PedigoLA,GibbsAJ,ScottRJ,etal.
Absenceofbacterialresistancefollowingrepeatexposuretophotodynamicther-apy[J].
SPIE,2009,7380,73803H.
[41]KimSY,KimEJ,ParkJW.
Controlofsingletoxygen-in-ducedoxidativedamageinEscherichiacoli[J].
JBiochemMolBiol,2002,35:353-357.
[42]NakoniecznaJ,MichtaE,RybickaM,etal.
SuperoxidedismutaseisupregulatedinStaphylococcusaureusfollow-ingprotoporphyrin-mediatedphotodynamicinactivationanddoesnotdirectlyinfluencetheresponsetophotody-namictreatment[J].
BMCMicrobiology,2010,10:323.
[43]ZolfaghariPS,PackerS,SingerM,etal.
InvivokillingofStaphylococcusaureususingalight-activatedantimicrobialagent[J].
BMCMicrobiol,2009,9:27.
[44]RagasX,DaiT,TegosGP,etal.
Photodynamicinactiva-tionofAcinetobacterbaumanniiusingphenothiaziniumdyes:invitroandinvivostudies[J].
LasersSurgMed,2010,42:384-390.
[45]DaiT,TegosGP,ZhiyentayevT,etal.
Photodynamicther-apyformethicillin-resistantStaphylococcusaureusinfec-tioninamouseskinabrasionmodel[J].
LasersSurgMed,2010,42:38-44.
[46]AndersenR,LoebelN,HammondD,etal.
Treatmentofperiodontaldiseasebyphotodisinfectioncomparedtoscal-ingandrootplaning[J].
JClinDent,2007,18:34-38.
(收稿日期:2011-10-11)·921·中国激光医学杂志2012年4月第21卷第2期ChinJLaserMedSurg,April2012,Vol21,No.
2
光动力疗法是治疗肿瘤、血管性疾病的一种新的方法.
目前的研究表明光动力疗法可以有效杀伤致病菌,为治疗感染性疾病提供了一种新的思路.
本文为光动力灭菌影响因素、其作用位点方面研究进展的综述.
随着新型光敏剂的不断开发、光动力影响因素研究的深入、光动力治疗方法的不断成熟,光动力灭菌将具有广阔的应用前景.
关键词细菌;感染性疾病;光动力疗法中图分类号:R454.
2文献标识码:A文章编号:1003-9430(2012)02-0122-08基金项目:国家自然科学基金资助项目(81171633、60878055、61036014)作者单位:1.
解放军总医院激光医学科(北京市,100853)2.
南开大学医学院作者简介:王钰铖(1987~),女,湖北黄冈人,在读医学硕士,主要从事激光医学的基础研究和临床应用研究.
*通讯作者ProgressinResearchofAntimicrobialPhotodynamicTherapyWANGYu-cheng1,2,GUYing1*,HUANGNai-yan11.
DepartmentofLaserMedicine,ChinesePLAGeneralHospital,Beijing100853,China2.
SchoolofMedicine,Nan-kaiUniversityABSTRACTBacterialinfectionisacommonclinicalproblem.
Theemergenceofantibioticresistantbacteriaisaseverechallengetomedcialwork.
Photodynamictherapy(PDT)isanewmodalityforcancerandvasculardiseases.
RecentresearthshowedthatPDTcaneffective-lykillpathogens,thusprovidinganewideaforthetreatmentofinfectiousdiseases.
TheprogressinresearchofinfluencefactorsandtheroleofPDTisreviewedinthispaper.
Alongwiththedevelopmentofnewphotosensitiers,furtherresearchonthephotodynamicin-fluencefactors,thematureofPDT,PDTwillhaveabroadprospectinitsapplicution.
KeywordsBacteria;Infectivedisease;Photodynamictherapy背景感染性疾病在全球人口死亡原因中占重要比重.
随着抗生素的普遍应用及不断升级,致病菌感染并未得到完全控制.
相反,许多致病菌或条件致病菌在环境选择的压力下,通过变异发展出一套有效抵御多种抗生素杀伤的能力.
其中对三类及三类以上抗生素同时耐药的现象称之为多重耐药(multi-drugresistant,MDR).
由多重耐药菌引起的感染已·221·中国激光医学杂志2012年4月第21卷第2期ChinJLaserMedSurg,April2012,Vol21,No.
2经成为严重影响患者健康和医疗安全的严重问题.
近年来多重耐药菌的加速出现与临床上抗生素的不合理使用有关.
在抗生素滥用形成的选择性压力下,抗生素敏感株被淘汰,原来只占很少比例的耐药菌株被保留下来,并不断扩大,逐渐成为优势菌株.
而变异产生的耐药基因或质粒还可在菌体间通过接合、转导等方式传递,再次增加了耐药菌株产生的速度.
当感染的微生物对一线药物产生耐药性后,就必须使用更昂贵、心肾毒性更大的抗生素进行治疗,往往导致住院时间延长、医疗费用增加,给家庭及社会带来沉重的经济负担.
国外研究比较了46例感染耐药肠杆菌的患者及113例感染非耐药肠杆菌的患者,死亡率分别为46%和13%,平均住院时间分别是29.
5d和19d,每例患者医疗费用分别是$79323元和$40406元,差异显著[1].
没有有效的抗生素治疗或预防感染,器官移植、癌症化疗和大型手术等治疗的成功率也会大打折扣.
多重耐药菌引起的感染导致的高死亡率、高住院费用已经使医务工作者面临着严峻的考验.
2010年8月,英国医学期刊《柳叶刀》公布了一种携带"新德里金属蛋白酶-1(NDM-1)"基因的细菌,这种细菌对目前临床上常用的几乎所有抗生素都有极强的耐药性,被称为"超级细菌"[2].
目前临床上常用的抗感染药物和方法对此类感染的疗效都十分有限.
一旦出现具有社区感染能力的泛耐药菌感染,后果将十分严重,必然导致公共卫生事业面临危机.
对致病菌感染的传统治疗方法是抗生素治疗,但抗生素研发周期长达10年,而致病菌则可在短时间内产生耐药性,抗生素的研发速度远远赶不上细菌耐药特性产生的速度.
耐药菌的出现是临床需要不断面对的问题,因此有必要采用一种有效并且不易产生耐受性的方法来替代或者辅助传统的抗生素治疗.
光动力灭菌概述光动力疗法(photodynamictherapy,PDT)是目前国际上正在发展的一种新技术,已经成功应用于肿瘤的治疗,成为手术、放疗、化疗之外的第四种疗法.
其基本原理是光敏剂(photosensitizer,PS)在合适的光源照射下,从基态经寿命极短的单线态,系间穿越到三线态.
受光激发的三线态光敏剂可进行两种形式的反应:(1)经过氢原子或电子转移,直接同底物或溶剂反应,形成自由基,为Ⅰ型(TypeⅠ)反应;(2)能量转移到氧分子,形成单线态氧1O2,为Ⅱ型(TypeⅡ)反应.
通过Ⅰ型、Ⅱ型反应产生的以单线态氧为代表的一系列毒性活性产物可以与细胞或微生物的磷脂、核酸和蛋白质等生物大分子反应,破坏生物膜结构或其他功能单位,使细胞或微生物死亡,从而达到治疗效果.
光敏剂分子的结构特点使其更易聚集在生长旺盛的细胞中,因此肿瘤细胞是良好的作用靶点,同时微生物由于繁殖迅速,比正常体细胞对光敏剂亲和性更强,因此,PDT可选择性作用于感染的微生物,是一种有效的杀灭微生物的方法.
最早报道光动力作用的是1900年慕尼黑的医科大学生OscarRaab,他发现用吖啶作为光敏剂,光照下可杀死草履虫.
20世纪初期,人们陆续发现几种可以作为光敏剂的物质,如抗细菌的吖啶普鲁黄(acridinesproflavine)、吖啶黄(acriflavine)及对细菌和真菌有杀伤作用的三苯代甲烷(triphenylmeth-anes)、结晶紫(crystalviolet)、亮绿(brilliantgreen).
在第一次世界大战时期,PDT灭活微生物被用于战伤感染的治疗,挽救了许多生命.
但随着"抗生素时代"的来临,PDT在抗感染方面的研究并没有得到重视,相反在恶性疾病中的应用则取得了很大的突破.
在美国,以Photofrin为光敏药物的抗肿瘤PDT已于1996年获得FDA批准;在加拿大、法国、荷兰、德国、英国、日本等二十几个主要发达国家,PDT也先后取得合法地位.
研究证明PDT能缓解食管癌[3]、膀胱癌[4]等恶性肿瘤患者临床症状、延缓病情进展、延长生存期、提高生活质量.
抗生素耐药菌的大量出现,使光动力抗微生物化学疗法(pho-todynamicantimicrobialchemotherapy,PACT)或抗微生物光动力疗法(antimicrobialphotodynamicthera-py,aPDT)的应用重新受到越来越多研究人员的关注.
与传统的抗生素治疗相比,光动力灭菌有以下优势:(1)抗菌谱广,可作用于细菌、真菌、病毒、原虫等;(2)对耐药菌株也同样有效;(3)能够通过一定的PDT方案在对宿主组织没有损害的条件下,有效杀伤病原微生物;(4)多次治疗后不会产生对PDT耐受的情况;(5)无致畸性;(6)光源及光敏剂造价低廉;(7)可通过多种给药方式使光敏剂到达感染处;(8)光敏剂毒副作用低,对肝肾功能影响小;(9)对正常组织影响小,年老体弱的患者也可以接受治疗;(10)无需长期用药,不受患者依从性影响;(11)在缺乏血运的感染部位也可起效,可以用于抗生素无法治疗的坏死组织感染;(12)对微生物分泌的毒性因子同样有灭活作用.
PDT用于灭活微·321·中国激光医学杂志2012年4月第21卷第2期ChinJLaserMedSurg,April2012,Vol21,No.
2生物、治疗感染方面有极好的应用前景.
光动力灭菌的影响因素一、光敏剂因素1.
光敏剂离子特性的影响高效光敏剂是提高光动力效率的重要前提.
光敏剂分子须具有以下特点:能吸收可见光,激发到三线态,能有效地将电子或能量转移给其他分子.
一般来说,革兰氏阳性菌对阳离子、中性及阴离子光敏剂介导的光动力反应均敏感,革兰氏阴性菌比阳性菌更难杀灭,只有用阳离子光敏剂才能产生明显的PDT杀伤作用[5,6],这是因为革兰氏阳性菌细胞壁中穿插有脂蛋白、脂磷壁酸形成相对多孔的结构,对光敏剂屏障作用较弱,不同离子特性的光敏剂几乎都有一定的通透性.
而革兰氏阴性菌细胞壁在肽聚糖层外还有三层结构,由内向外依次为脂蛋白、脂质双层和脂多糖,三层共同构成外膜,外膜具有通透性屏障作用,能阻止多种大分子(包括光敏剂)进入.
阳离子型光敏剂通过"自促进吸收过程(self-promoteduptakepath-way)"渗透进入革兰氏阴性菌:细胞壁上有Mg2+、Ca2+等二价阳离子锚定在细胞壁外带负电荷的脂多糖(LPS)上,阳离子光敏剂置换这些二价阳离子,使细菌外膜的屏障功能减弱,允许更多的光敏剂通过或结合于细胞壁,进一步增加细胞屏障的通透性引起更多光敏剂的吸收[7].
因此阳离子光敏剂能通过这种链式反应过程与革兰氏阴性菌结合或渗透进入外膜,携带正电荷的量与光敏剂对革兰氏阴性菌的光动力效应密切相关.
阳离子型的卟啉类光敏剂以脂质体形式存在时,对革兰氏阴性菌的光动力效应减弱[8].
在中性或碱性环境下,细菌表面带有负电荷,即使是革兰氏阳性菌,阳离子光敏剂的光动力杀伤作用也更有效,因为它与细菌有更强的静电吸引力.
但与针对革兰氏阴性菌不同,革兰氏阳性菌的光动力杀伤对电荷量的要求相对较低.
带有较少正电荷量的较小光敏剂分子与带正电荷量多的大分子光敏剂相比,前者能达到更好的PACT效果[9,10].
这是因为革兰氏阳性菌的细胞壁多孔结构类似于"分子筛",分子量小的光敏剂更易透过细胞壁.
几种不同的合成菌绿素(bacteriochorin)作为光敏剂时,带正电荷最多的光敏剂对革兰氏阴性菌PACT效应最为明显;而对革兰氏阳性菌,正2价光敏剂PACT效应优于正4价、正6价及电中性光敏剂.
研究者认为,光敏剂要结合于细菌表面的阴离子基团或渗透入细胞,需携带合适的电荷,对革兰氏阴性菌,正电荷多有利于光敏剂与LPS结合并增加细胞壁通透性;而对于革兰氏阳性菌,携带正电荷太少,光敏剂不足以结合于带负电的细胞壁,带正电荷太多,光敏剂与细胞壁结合太紧密,也不利于光敏剂渗透进入细胞壁[5].
2.
光敏剂溶解性的影响光敏剂的PACT效应还与光敏剂的溶解性有关.
Huang等[11]在设计的几种碳簇分子(fullerenes)中归纳出光敏剂携带的正电荷数本身就与脂水分配系数(LogP)有关,他们强调正电荷数及水溶性对光敏剂光动力灭菌效应的重要性.
还有研究认为,正电荷数越多,光敏剂与荷负电的细胞壁之间的静电引力越强,光敏剂与细菌细胞壁的结合越多;而脂溶性越强,光敏剂越容易穿透细菌结构中的脂质层,正电荷数多及脂溶性强协同作用可增强光敏剂的脂水双溶性,进而增加它们对细菌的亲和力[12],增加对细菌的光动力杀伤效应.
Alves等[13]比较了7种不同电荷量、不同电荷分布的阳离子型的卟啉类衍生物的PACT活性.
在PDT组中,7种卟啉类衍生物对革兰氏阳性菌粪肠球菌(E.
faecalis)都有完全的杀伤;而对革兰氏阴性菌大肠杆菌(E.
coli),仅3价(Tri-Py+-Me-PF、Tri-Py+-Me-CO2Me)及4价(Tetra-Py+-Me)阳离子光敏剂在最高浓度5.
0μM,光剂量为21.
6~64.
8J/cm2时细菌杀伤完全.
随着正电荷量减少,PACT对革兰氏阴性菌的杀伤作用依次减弱.
具有最强的PACT效应的是其中一种3价阳离子光敏剂Tri-Py+-Me-PF.
这种光敏剂虽然电荷数不是最大的,但它具有不对称的正电荷分布,因而与其他几种分子相比有最强的脂水双溶性(LogPB/W=-0.
17).
他们认为正电荷数及脂水双溶性共同决定了光敏剂的光动力灭菌效能.
这与Kessel等[14]的研究一致.
3.
光敏剂浓度及孵育时间的影响一般认为,光动力对细菌的杀伤作用是与光敏剂浓度、光剂量呈正相关.
但一些研究则认为,光敏剂浓度过高时,有一部分光敏剂未与细菌结合,不仅不能产生有效的光动力杀伤作用,反而会发生光遮蔽效应,影响杀菌效果[15].
调整治疗的光剂量时,也必须考虑到过高的激光功率密度和过长的光照时间可造成机体正常组织的非特异损伤.
光敏剂给药-光照间隔时间(PS-illuminationinterval)也是光动力方案的重要内容.
Schastak等[16]研究了PDT对四种细菌的杀伤效果:在相同光剂量下,提高光敏剂四氢卟啉四甲苯磺酸酯(tetrahydroporphyrintetratosylat,THPTS)浓度·421·中国激光医学杂志2012年4月第21卷第2期ChinJLaserMedSurg,April2012,Vol21,No.
2能增加杀伤效果;对甲氧西林敏感金黄色葡萄球菌(methicillin-susceptibleStaphylococcusaureus,MSSA),给药-光照间隔30min,即可达到理想的杀伤效果,增加间隔时间(90、180min),细菌杀伤效果不变;对耐甲氧西林金黄色葡萄球菌(methicillin-re-sistantStaphylococcusaureus,MRSA),给药-光照间隔为30min可达最大效果,但随着时间延长,效应减弱,这可能是由MRSA对光敏剂的代谢所致;对大肠杆菌和铜绿假单胞菌(P.
Aeruginosa),孵育时间为90min时才能达到最大杀伤效果.
Cassidy等[17]认为革兰氏阳性菌和革兰氏阴性菌的最佳给药光照间隔有所不同,对金黄色葡萄球菌,30min是最佳间隔时间;对铜绿假单胞菌最佳间隔时间是30s,孵育时间延长,光动力杀伤作用并不能提高.
他们解释,一些光敏剂是多药外排泵底物,因此延长光敏剂与细菌的孵育时间,并不能促进光敏剂与细菌结合或渗透入细菌体内,因而不能增加光动力杀菌效应.
二、细菌自身因素1.
细菌细胞壁通透性的影响光动力灭菌效果的一个有效途径是增加细胞屏障对光敏剂的通透性,非阳离子光敏剂与增加细菌屏障通透性的物质(如EDTA[18]、多粘菌素B[19])联合使用能提高对革兰氏阴性菌的光动力杀菌效应.
Yujie等[20]研究证明用CaCl2、MgCl2预处理会显著提高竹红菌甲素(HA)介导的PACT效应,甚至使对HA介导的光动力作用不敏感的E.
coli存活率降到5%以下.
他们认为CaCl2、MgCl2等物质能增加革兰氏阴性菌外膜通透性,使光敏剂分子或活性氧(reactiveoxygenspecies,ROS)定位于内膜或渗透进入胞质内,对细菌产生杀伤.
带正电荷的多肽与带负电的光敏剂二氢卟吩e6(chlorine6,Ce6)混合,能显著增加Ce6的光动力杀菌效应[6],也证明增加细胞屏障的通透性有利于光动力杀伤细菌.
2.
细菌生长状态的影响细菌根据生长状态可分为浮游(planktonic)状态和生物膜(biofilm)状态,细菌的生物膜较单个粘附的或混悬的细菌更易于抵抗免疫细胞、免疫分子及药物的攻击,并可克服液态流的冲击而持续生存,还可通过接合机制快速传递耐药基因,效率高于单个悬浮菌的一万倍,许多生物医学植入物,如中央静脉插管、导尿管、人工心脏瓣膜、关节替代物等被细菌粘附并形成生物膜,是引起慢性感染的重要原因,也是医源性感染微生物耐药性大大高于非医源性感染微生物的重要原因.
Donnelly等[15]观察了两种光敏剂介导的PDT对MRSA浮游菌及生物膜的杀伤效应:亚甲基蓝(methyleneblue,MB)引起的光动力效应对不同状态的MRSA有显著差异,浮游状态生长的细菌与细菌生物膜相比,对相同的PDT方案(10μg/ml,100J/cm2)更加敏感(前者细菌杀伤99.
99%,后者为88.
19%);meso-四(N-甲基-4-吡啶基)卟啉(me-so-tetra(N-methyl-4-pyridyl)porphinetetratosylate,TMP)引起的光动力效应对两种状态的MRSA没有明显差异(细菌杀伤均>99.
7%).
Street等[21]研究了牙菌斑中三种常见细菌牙龈类杆菌(P.
gingivalis)、核梭杆菌(F.
nucleatum)、伴放线放线杆菌(A.
actinomycetemcomitans)在不同状态时对PDT的敏感性,他们以MB为光敏剂,光剂量为9.
4J/cm2(670nm)时,引起浮游状态的细菌与对照组相比分别减少了(6.
8±0.
7)、(5.
2±0.
6)、(1.
9±0.
6)log10,生物膜状态的细菌与对照组相比分别减少(4.
5±1.
2)、(3.
4±1.
1)、(4.
9±1.
4)log10.
Pagonis等[22]以体外浮游状态及牙髓腔中生物膜状态的E.
faecalis为模型,发现两种状态的细菌对MB介导的PDT敏感性类似.
由于细菌生长、代谢速度的差异,不同生长期的细菌对PACT的敏感性也可能存在差异,处于对数生长期与处于平台期的细菌相比,前者对PACT更加敏感[17].
细菌密度较低时PACT引起的细菌数降低更显著[23].
三、环境因素1.
血清的影响光动力杀菌效应还受到环境中多种复杂因素的影响.
在Donnelly等[15]的研究中,MB在血清存在的条件下,光动力杀菌效应仅为不含血清时的23%,并且增加光剂量不能增加其光动力效应.
而TMP的PDT效应则不受血清的明显影响.
他们认为,MB介导的光动力效应受血清的影响可能是由于MB与血清成分结合,从而阻碍了MB与菌体的作用,这与Nitzan等[24]的研究一致;而TMP介导的光动力效应不受血清影响,是由于TMP的脂溶性及电荷分布有别于MB,与血清成分结合较少,因此血清对TMP介导的PACT效应影响较小.
Schastak等[16]的研究也表明,10%血清能明显降低PDT的细菌杀伤效应,尤其是铜绿假单胞菌在血清存在下对高浓度光敏剂介导的PDT几乎完全抵抗.
他们认为,血清蛋白可能与细菌细胞壁上的脂多糖环境(糖基化状态、电荷等)相互作用,改变细菌渗透性,降低光敏剂与细菌的亲和力.
调整光敏剂浓度及光敏剂给药-光照间隔时间有可能抵消·521·中国激光医学杂志2012年4月第21卷第2期ChinJLaserMedSurg,April2012,Vol21,No.
2血清对PACT效应的负向影响.
2.
氧浓度的影响光动力反应中,Ⅰ型反应无需氧环境,而Ⅱ型反应在有氧时才能发生.
在Yujie等[20]的研究中,用N2代替空气模拟无氧环境,发现缺氧使灭菌效应减弱.
Feuerstein等[25]实验证明,在无氧条件下,PDT对P.
gingivalis、F.
nucleatum的治疗效果与有氧条件下比较明显减弱.
Burns等[26]则认为无氧条件对变异链球菌的PDT效果无明显影响.
对缺氧条件的敏感程度不同,可由光动力过程中Ⅰ、Ⅱ型反应比例不同来解释,这一比例受光敏剂、底物、氧浓度以及光敏剂与底物结合程度的影响.
Street等[21]在PDT组用单线态氧清除剂L-色氨酸预处理,明显降低光动力作用对细菌的杀伤作用,证明单线态氧是PDT杀伤细菌的重要参与者.
HA介导的光动力反应中,同时清除光动力Ⅰ、Ⅱ型反应产物使细菌生存率获得最大幅度的提高,证明Ⅰ、Ⅱ型反应是同时存在、共同产生活性产物并发挥灭菌作用的[20].
Hamblin等[9]认为PDT对革兰氏阴性菌的杀伤过程中Ⅰ型反应产物起主要作用.
PACT的选择性PACT用于体内抗感染的前提是对机体正常组织无害,即选择性杀伤细菌.
光动力杀伤效应的选择性主要基于以下原理:一方面,宿主的正常组织细胞只能通过"内吞"的方式缓慢吸收光敏剂,而光敏剂被微生物吸收或与之结合是相对较快的过程[6];另一方面,光动力作用产生的单线态氧扩散范围约为100~200nm,由于真核细胞体积比原核细胞大2000倍,对微生物细胞,单线态氧能扩散到细胞内重要的结构产生致命损伤;而对于宿主细胞,由于自由基扩散距离的限制,无法对更敏感的胞内结构产生致命损害[6].
若光敏剂给药-光照间隔时间超过一定范围,则光敏剂可以缓慢"内吞"进入体细胞内,活性物质定位于细胞内重要结构,可造成非特异组织的损伤.
选择合适的光敏剂给药-光照间隔时间,可以提高光动力灭活微生物效果,并尽可能减少对机体正常组织的副作用.
有研究认为,细菌在与光敏剂孵育较短时间内(10~30min),PDT对细菌杀伤作用强,而对机体正常组织影响小[27,28].
光敏剂的种类、性质对细胞杀伤的选择性也有影响.
将带电情况不同的合成菌绿素作为光敏剂与细菌或Hela细胞分别孵育30min后光照发现,阳离子光敏剂对细菌的光动力杀伤效应为对Hela细胞杀伤的50倍以上,而中性光敏剂的选择性较差[5].
研究者认为,Hela细胞为真核结构,与原核细胞对光敏剂的要求有所不同,对中性光敏剂介导的光动力杀伤更敏感.
多聚赖氨酸共轭吩(polylysine-chlorin(e6)conjugate,pL-Ce6)及Ce6单体与细菌、上皮细胞系HCPC-1分别孵育1min后,细菌的对带正电荷的pL-Ce6的吸收是HCPC-1的30~100倍,阳离子型的pL-Ce6介导的光动力杀伤效应有很好的选择性[6].
PACT作用位点一般认为,光敏剂与微生物的结合主要有三种方式:(1)光敏剂紧密结合于微生物体或进入微生物体内[29];(2)光敏剂与微生物体松散可逆性结合[20];(3)未结合于微生物体[30].
细菌与光敏剂的结合方式依赖于光敏剂分子本身的化学性质及细菌种类[23].
Dahi等[31]用玫瑰红染料作光敏剂,以沙门氏菌为靶生物,用荧光反应观察玫瑰红在细菌上的分布,发现其主要在膜系统上,尤其在细胞壁上,而非在细胞体内.
Pagonis等[22]将含光敏剂MB的纳米颗粒和细菌共同孵育10min,在扫描电镜下观察纳米颗粒的形态及聚集部位,结果发现MB纳米颗粒大量聚集在细胞壁上,他们认为光动力作用对细菌的杀伤起始于细胞壁.
PACT可以破坏微生物质膜,引起细胞内容物渗漏[9],或使细胞膜上的转运系统和酶失活[32],一旦破坏细菌屏障结构,光敏剂进入菌体内,PACT产生的自由基则对多种生物分子如DNA、蛋白、脂质产生非特异性损伤.
Choi等[33]研究了MB在光照下对幽门螺杆菌的光动力反应,他们对处理后各组细菌DNA进行琼脂糖凝胶电泳,发现光动力组中DNA电泳条带弥散不清;定量检测各组中DNA氧化产物8-OHdG,发现PDT组中随着光照时间延长,该氧化产物的含量增加2~9倍(15min>10min>5min>0min).
除细菌本身的侵袭力,细菌产生、释放的毒素因子也是对宿主的严重威胁.
用抗生素治疗感染往往只能杀灭细菌本身,而不能灭活内、外毒素因子.
光动力治疗不仅能有效杀伤致病菌,还能灭活细菌毒素因子.
Tubby等[34]研究了光动力灭活葡萄球菌释放的几种毒素因子的效果,发现V8蛋白酶、α溶血素、神经鞘磷脂酶活性受到抑制,并且这种抑制效应与光剂量有依赖性.
Komerik等[35]也证明了甲苯胺蓝(toluidineblue,TBO)与红光联合作用可以有效灭活大肠杆菌及铜绿假单胞菌释放的毒素因子.
·621·中国激光医学杂志2012年4月第21卷第2期ChinJLaserMedSurg,April2012,Vol21,No.
2细菌对PDT的耐受性DNA不是光动力杀伤细菌的主要位点[36],尽管细菌有DNA损伤修复功能,细菌对PDT不易出现耐受性[37].
Winckler等[38]指出,细菌的细胞壁和细胞膜是PACT作用的主要靶点,光敏剂无需进入细菌体内,而只要与细菌的膜系统结合,在合适的光照下即可产生严重的细胞结构破坏.
细菌无法通过减少光敏剂吸收、增加光敏剂的代谢以及增加光敏剂的主动外排来实现对光动力的耐受性.
Tavares等[39]以5.
0μM的Tri-Py+-Me-PF为光敏剂,用功率密度为40w/cm2的白光照射270min,使V.
fischeri数量减少5.
1log10、E.
coli数量减少6.
4log10,继续培养后,未见细菌生长,证明光动力作用对细菌的杀伤是完全的和不可逆的.
他们还发现重复多次的PDT治疗不会诱导细菌对PDT耐受性的出现.
Pedigo等[40]也证明经过多次重复的PDT治疗,MR-SA、MSSA及E.
coli对PDT的敏感性没有下降.
Cassidy等[17]则研究了亚致死剂量的PDT(使细菌数量仅减少0.
5~1.
0log10的方案)能否影响金黄色葡萄球菌及铜绿假单胞菌对抗生素及致死剂量的PDT方案(使细菌数减少2log10的方案)的敏感性.
结果表明,与对照组相比,光动力处理并不降低两种细菌对抗生素的敏感性.
这一发现提示了光动力辅助传统抗生素用于抗感染治疗的可能性.
部分菌株对TMP或MB介导的光动力反应敏感性有不同程度的下降,但只有金黄色葡萄球菌的某一菌株对MB介导的光动力杀伤效应敏感性降低明显.
他们认为对光动力的耐受性不易产生是因为ROS仅在光照时产生,不足以诱导菌体产生抗氧化酶,如超氧化物歧化酶(superoxidedismutase,SOD);而部分菌株产生了一定的耐受性则可能是由于亚致死剂量的光动力方案上调了多药外排泵或抗氧化酶的表达,这种现象是因使用的光敏剂种类及菌株而异的.
Kim等[41]最近的研究表明MB介导的光动力反应引起大肠杆菌内主要的抗氧化酶表达上调及oxyR基因过表达,从而对MB-PDT引起的细菌杀伤有保护作用.
Nakonieczna等[42]发现对PDT的敏感性依菌株而异,只有对PDT敏感的菌株在光动力处理后才能观察到SOD的表达上调,暗示抗氧化因子的产生可能不是影响光动力敏感性的直接因素.
PACT在体研究及前景光动力治疗过程包括两个步骤:(1)光敏剂给药;(2)用合适的光源对病变组织或微生物感染部位进行照射.
肿瘤的光动力治疗通常用静脉给药方式,光敏剂随着血液循环到全身,并富集到代谢旺盛的肿瘤组织内,进而发生一系列的光化学反应,近年来也有一些局部给药和口服给药的报道.
而在微生物的PDT灭活过程中,如果也采用静脉给药,则到达局部的微生物时,光敏剂浓度已经很小,因此光敏剂主要采用局部给药的方式,如滴注、局部注射、气溶胶等方式.
Donnelly等[15]使用包含光敏剂MB或TMP的聚乙烯凝胶敷贴于局部,发现光敏剂能缓慢释放到组织中,并且释放速度与组织的温度正相关,这种凝胶具有一定的硬度,形状可塑,硬度和形态不受血清和渗出物的影响,因此可根据体表创伤的形状、大小局部应用,光敏剂释放达一定浓度后可去掉凝胶聚合物,进行光动力治疗,这是一种新的、有前景的光敏剂局部给药方式.
由于宿主细胞对光敏剂的吸附、对光的遮蔽以及对自由基的清除等原因,目前光动力灭菌在体内模型中的效果较体外PACT差[43],但一些动物实验仍预示了光动力抗感染在体内应用的前景.
Ragas等[44]用4种吩噻嗪类光敏剂对多重耐药的鲍曼不动杆菌进行体外的灭菌实验和在体的小鼠感染模型实验,结果表明4种光敏剂都能有效杀灭鲍曼不动杆菌,并且小鼠感染模型中的细菌没有出现再感染的情况.
Dai等[45]用酞青类光敏剂-PDT治疗大鼠皮肤MRSA感染的模型,观察到伤口愈合比对照组提前8.
6d.
Zolfaghari等[43]在小鼠体表伤及切割伤模型中验证了MB介导的光动力杀菌作用,在光动力处理后,从伤口中分离到的MRSA明显减少.
组织病理学显示伤口周围组织的表皮完整,未出现广泛坏死.
PDT后24h组织病理学检查结果也显示创伤部位没有扩大.
最近一些研究也报道了光动力灭菌治疗牙周炎的成功病例[46].
受光源穿透深度及辐照范围的限制,光动力对致病菌的杀伤主要用于治疗局部感染,如皮肤、软组织的感染.
随着光纤及内镜技术的发展,PACT也可用于呼吸道、消化道、泌尿道等腔道内感染的治疗.
随着新型光敏剂的不断开发、光动力影响因素研究的深入、光动力治疗方法的不断成熟,PACT辅助甚至在一些感染性疾病中取代抗生素治疗将成为可能,这将彻底改变传统的抗感染理念,缓解正日趋面临的抗生素耐药危机,必将翻开人类与致病菌斗争史上重要的一页.
·721·中国激光医学杂志2012年4月第21卷第2期ChinJLaserMedSurg,April2012,Vol21,No.
2参考文献[1]CosgroveSE,KayeKS,EliopoulousGM,etal.
Healthandeconomicoutcomesoftheemergenceofthird-generationcephalosporinresistanceinEnterobacterspecies[J].
ArchInternMed,2002,162:185-190.
[2]KumarasamyKK,TolemanMA,WalshTR,etal.
Emer-genceofanewantibioticresistancemechanisminIndia,Pakistan,andtheUK:amolecular,biological,andepide-miologicalstudy[J].
LancetInfectDis,2010,10:597-602.
[3]LuketichJD,ChristieNA,BuenaventuraPO,etal.
Endo-scopicphotodynamictherapyforobstructingesophagealcancer:77casesovera2yearperiod[J].
SurgEndosc,2000,14:653-657.
[4]WaltherMCM.
Theroleofphotodynamictherapyinthetreatmentofrecurrentsuperficialbladdercancer[J].
Uro-logicClinicsofNorthAmerica,2000,27:163-170.
[5]HuangL,HuangYY,MrozP,etal.
Stablesyntheticcat-ionicbacteriochlorinsasselectiveantimicrobialphotosensi-tizers[J].
AntimicrobAgentsChemother,2010,54:3834-3841.
[6]SoukosNS,Ximenez-FyvieLA,HamblinMR,etal.
Targe-tedantimicrobialphotochemotherapy[J].
AntimicrobA-gentsChemother,1998,42:2595-2601.
[7]GeorgeS,HamblinMR,KishenA.
Uptakepathwaysofan-ionicandcationicphotosensitizersintobacteria[J].
Photo-chemPhotobiolSci,2009,8:788-795.
[8]MerchatM,SpikesJD,BertoloniG,etal.
Studiesonthemechanismofbacteriaphotosensitizationbymeso-substitu-tedcationicporphyrins[J].
JPhotochemPhotobiolB,1996,35:149-157.
[9]HamblinMR,O'DonnellDA,MurthyN,etal.
Polycationicphotosensitizerconjugates:effectsofchainlengthandgramclassificationonthephotodynamicinactivationofbacteria[J].
JAntimicrobChemother,2002,49:941-951.
[10]TegosGP,AnbeM,YangC,etal.
Protease-stablepolyca-tionicphotosensitizerconjugatesbetweenpolyethylenei-mineandchlorin(e6)forbroad-spectrumantimicrobialphotoinactivation[J].
AntimicrobAgentsChemother,2006,50:1402-1410.
[11]HuangL,TerakawaM,ZhiyentayevT,etal.
Innovativecationicfullerenesasbroadspectrumlightactivatedanti-microbials[J].
Nanomedicine,2010,6:442-452.
[12]LazzeriD,RoveraM,PascualL,etal.
Photodynamicstud-iesandphotoinactivationofEscherichiacoliusingmeso-substitutedcationicporphyrinderivativeswithasymmetricchargedistribution[J].
PhotochemPhotobiol,2004,80:286-293.
[13]AlvesE,CostaL,CarvalhoCM,etal.
ChargeeffectonthephotoinactivationofGramnegativeandGram-positivebac-teriabycationicmesosubstitutedporphyrins[J].
BMCMi-crobiol,2009,9:70.
[14]KesselD,LuguyaR,VicenteMG.
Localizationandphoto-dynamicefficacyoftwocationicporphyrinsvaryinginchargedistributions[J].
PhotochemPhotobiol,2003,78:431-435.
[15]DonnellyRF,CassidyCM,LoughlinRG,etal.
DeliveryofMethyleneBlueandmeso-tetra(N-methyl-4-pyridyl)porphinetetratosylatefromcross-linkedpoly(vinylalco-hol)hydrogels:apotentialmeansofphotodynamicthera-pyofinfectedwounds[J].
JPhotochemPhotobiolB,2009,96:223-231.
[16]SchastakS,ZiganshynaS,GitterB,etal.
Efficientphoto-dynamictherapyagainstgram-positiveandgram-negativebacteriausingTHPTS,acationicphotosensitizerexcitedbyinfraredwavelength[J].
PLoSOne,2010,5:e11674.
[17]CassidyCM,DonnellyRF,TunneyMM.
Effectofsub-le-thalchallengewithphotodynamicantimicrobialchemo-therapy(PACT)ontheantibioticsusceptibilityofclinicalbacterialisolates[J].
JPhotochemPhotobiolB,2010,99:62-66.
[18]BertoloniG,RossiF,ValdugaG,etal.
Photosensitizingactivityofwater-andlipid-solublephthalocyaninesonEscherichiacoli[J].
FemsMicrobiolLett,1990,59:149-155.
[19]NitzanY,GuttermanM,MalikZ,etal.
Inactivationofgram-negativebacteriabyphotosensitizedporphyrins[J].
PhotochemPhotobiol,1992,55:89-96.
[20]YujieSu,JunSun,ShengqiRao,etal.
Photodynamicanti-microbialactivityofhypocrellinA[J].
JPhotochemPho-tobiolB,2011,103:29-34.
[21]StreetCN,PedigoLA,LoebelNG.
Energydoseparametersaffectantimicrobialphotodynamictherapymediatederadi-cationofperiopathogenicbiofilmandplanktoniccultures[J].
PhotomedLaserSurg,2010,28:S61-66.
[22]PagonisTC,ChenJ,FontanaCR,etal.
Nanoparticle-basedendodonticantimicrobialphotodynamictherapy[J].
JEndod,2010,36:322-328.
[23]DemidovaTN,HamblinMR.
Effectofcell-photosensitizerbindingandcelldensityonmicrobialphotoinactivation[J].
AntimicrobAgentsChemother,2005,49:2329-2335.
[24]NitzanY,Balzam-SudakevitzA,AshkenaziH.
Eradica-tionofAcinetobacterbaumanniibyphotosensitizedagentsinvitro[J].
JPhotochemPhotobiolB,1998,42:211-218.
·821·中国激光医学杂志2012年4月第21卷第2期ChinJLaserMedSurg,April2012,Vol21,No.
2[25]FeuersteinO,GinsburgI,DayanE,etal.
MechanismofvisiblelightphototoxicityonPorphyromonasgingivalisandFusobacteriumnucleatum[J].
PhotochemPhotobiol,2005,81:1186-1189.
[26]BurnsT,WilsonM,PearsonGJ.
MechanismofkillingofStreptococcusmutansbylight-activateddrugs[J].
SPIE,1996,2625:288-297.
[27]ZeinaB,GreenmanJ,CorryD,etal.
Cytotoxiceffectsofantimicrobialphotodynamictherapyonkeratinocytesinvitro[J].
BrJDermatol,2002,146:568-573.
[28]SoukosNS,WilsonM,BurnsT,etal.
Photodynamiceffectsoftoluidineblueonhumanoralkeratinocytesandfibro-blastsandStreptococcussanguisevaluatedinvitro[J].
La-sersSurgMed,1996,18:253-259.
[29]MinnockA,VernonDI,SchofieldJ,etal.
Photoinactiva-tionofbacteria.
Useofacationicwater-solublezincphthalocyaninetophotoinactivatebothgram-negativeandgram-positivebacteria[J].
JPhotochemPhotobiolB,1996,32:159-164.
[30]DahlTA,MiddenWR,HartmanPE.
Comparisonofkillingofgram-negativeandgram-positivebacteriabypuresin-gletoxygen[J].
JBacteriol,1989,171:2188-2194.
[31]DahlTA,Valdes-AguileraO,MiddenWR,etal.
Partitionofrosebengalanionfromaqueousmediumintoalipophil-icenvironmentinthecellenvelopeofSalmonellatyphi-murium:implicationsforcell-typetargetinginphotody-namictherapy[J].
JPhotochemPhotobiolB,1989,4:171-184.
[32]KomagoeK,KatoH,InoueT,etal.
Continuousrealtimemonitoringofcationicporphyrin-inducedphotodynamicin-activationofbacterialmembranefunctionsusingelectro-chemicalsensors[J].
PhotochemPhotobiolSci,2011,10:1181-1188.
[33]ChoiSS,LeeHK,ChaeHS.
Invitrophotodynamicantimi-crobialactivityofmethyleneblueandendoscopicwhitelightagainstHelicobacterpylori26695[J].
JPhotochemPhotobiolB,2010,101:206-209.
[34]TubbyS,WilsonM,NairSP.
Inactivationofstaphylococ-calvirulencefactorsusingalight-activatedantimicrobialagent[J].
BMCMicrobiol,2009,9:211.
[35]KomerikN,WilsonM,PooleS.
Theeffectofphotodynamicactionontwovirulencefactorsofgram-negativebacteria[J].
PhotochemPhotobiol,2000,72:676-680.
[36]MenezesS,CapellaMA,CaldasLR.
Photodynamicactionofmethyleneblue:repairandmutationinEscherichiacoli[J].
JPhotochemPhotobiolB,1990,5:505-517.
[37]SchaferM,SchmitzC,HorneckG.
HighsensitivityofDei-nococcusradioduranstophotodynamically-producedsin-gletoxygen[J].
IntJRadiatBiol,1998,74:249-253.
[38]WincklerKD.
Specialsection:focusonantimicrobialpho-todynamictherapy(PDT)[J].
JPhotochemPhotobiolB,2007,86:43-44.
[39]TavaresA,CarvalhoCM,FaustinoMA,etal.
Antimicrobi-alphotodynamictherapy:studyofbacterialrecoveryvia-bilityandpotentialdevelopmentofresistanceaftertreat-ment[J].
MarDrugs,2010,8:91-105.
[40]PedigoLA,GibbsAJ,ScottRJ,etal.
Absenceofbacterialresistancefollowingrepeatexposuretophotodynamicther-apy[J].
SPIE,2009,7380,73803H.
[41]KimSY,KimEJ,ParkJW.
Controlofsingletoxygen-in-ducedoxidativedamageinEscherichiacoli[J].
JBiochemMolBiol,2002,35:353-357.
[42]NakoniecznaJ,MichtaE,RybickaM,etal.
SuperoxidedismutaseisupregulatedinStaphylococcusaureusfollow-ingprotoporphyrin-mediatedphotodynamicinactivationanddoesnotdirectlyinfluencetheresponsetophotody-namictreatment[J].
BMCMicrobiology,2010,10:323.
[43]ZolfaghariPS,PackerS,SingerM,etal.
InvivokillingofStaphylococcusaureususingalight-activatedantimicrobialagent[J].
BMCMicrobiol,2009,9:27.
[44]RagasX,DaiT,TegosGP,etal.
Photodynamicinactiva-tionofAcinetobacterbaumanniiusingphenothiaziniumdyes:invitroandinvivostudies[J].
LasersSurgMed,2010,42:384-390.
[45]DaiT,TegosGP,ZhiyentayevT,etal.
Photodynamicther-apyformethicillin-resistantStaphylococcusaureusinfec-tioninamouseskinabrasionmodel[J].
LasersSurgMed,2010,42:38-44.
[46]AndersenR,LoebelN,HammondD,etal.
Treatmentofperiodontaldiseasebyphotodisinfectioncomparedtoscal-ingandrootplaning[J].
JClinDent,2007,18:34-38.
(收稿日期:2011-10-11)·921·中国激光医学杂志2012年4月第21卷第2期ChinJLaserMedSurg,April2012,Vol21,No.
2
- 光敏剂ya相关文档
- 学院wx
- 中小学生wx
- "姓名","学生类别","专业","年级","院系","手机","电子邮箱"
- 本站资源来源于网络收集,仅供学习交流,请勿用于商用.版权归原作者所有,
- 厦门市学生健康体检网络管理信息平台——操作培训
- Anthemmy
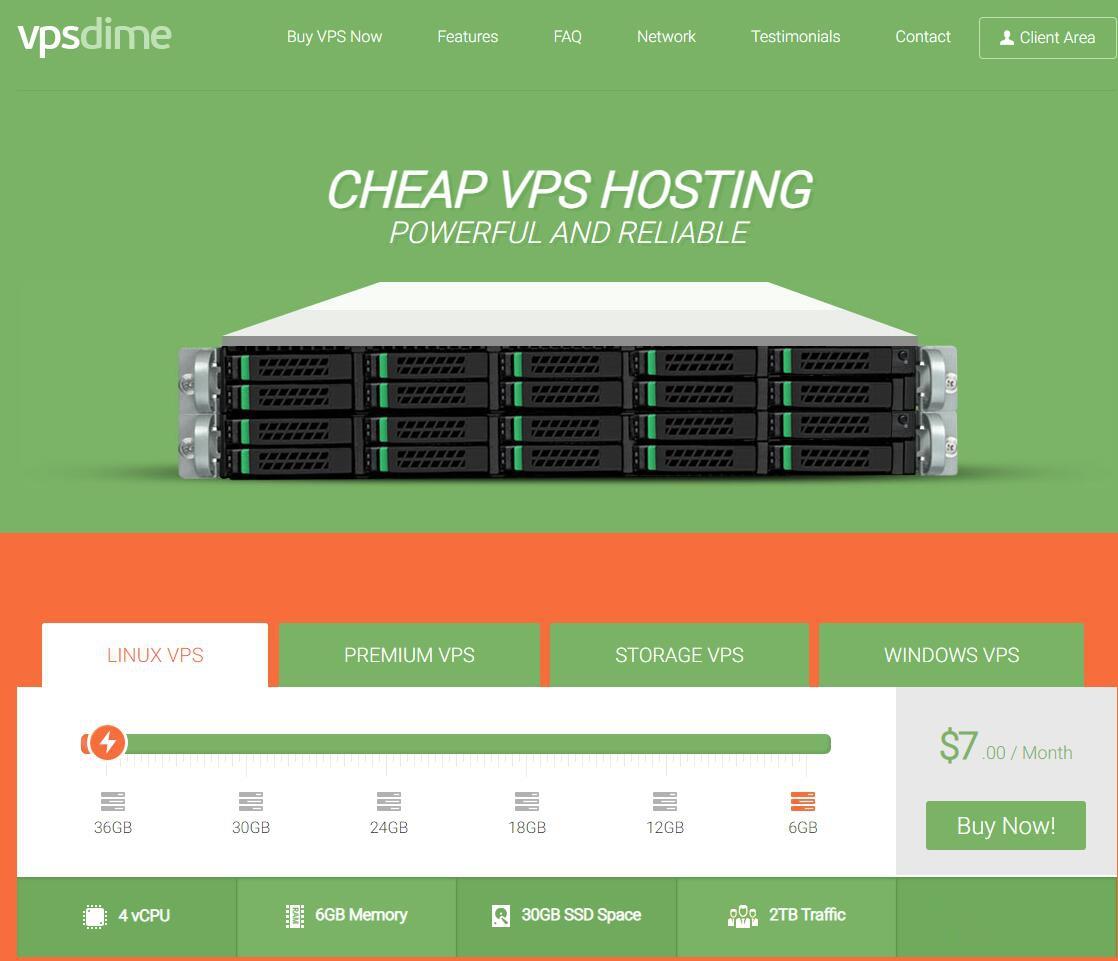
VPSDime7美元/月,美国达拉斯Windows VPS,2核4G/50GB SSD/2TB流量/Hyper-V虚拟化
VPSDime是2013年成立的国外VPS主机商,以大内存闻名业界,主营基于OpenVZ和KVM虚拟化的Linux套餐,大内存、10Gbps大带宽、大硬盘,有美国西雅图、达拉斯、新泽西、英国、荷兰机房可选。在上个月搞了一款达拉斯Linux系统VPS促销,详情查看:VPSDime夏季促销:美国达拉斯VPS/2G内存/2核/20gSSD/1T流量/$20/年,此次推出一款Windows VPS,依然是...
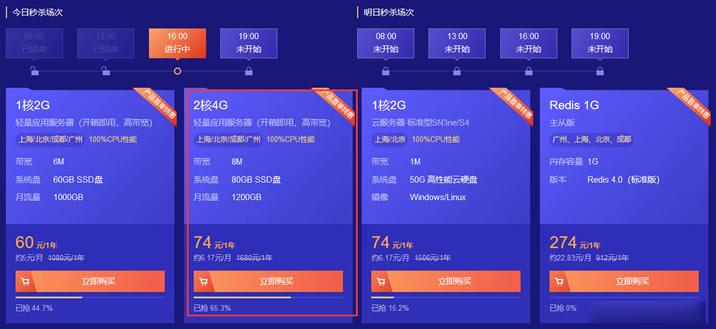
腾讯云轻量服务器两款低价年付套餐 2核4GB内存8M带宽 年74元
昨天,有在"阿里云秋季促销活动 轻量云服务器2G5M配置新购年60元"文章中记录到阿里云轻量服务器2GB内存、5M带宽一年60元的活动,当然这个也是国内机房的。我们很多人都清楚备案是需要接入的,如果我们在其他服务商的域名备案的,那是不能解析的。除非我们不是用来建站,而是用来云端的,是可以用的。这不看到其对手腾讯云也有推出两款轻量服务器活动。其中一款是4GB内存、8M带宽,这个比阿里云还要狠。这个真...
HostKvm:夏季优惠,香港云地/韩国vps终身7折,线路好/机器稳/适合做站
hostkvm怎么样?hostkvm是一家国内老牌主机商家,商家主要销售KVM架构的VPS,目前有美国、日本、韩国、中国香港等地的服务,站长目前还持有他家香港CN2线路的套餐,已经用了一年多了,除了前段时间香港被整段攻击以外,一直非常稳定,是做站的不二选择,目前商家针对香港云地和韩国机房的套餐进行7折优惠,其他套餐为8折,商家支持paypal和支付宝付款。点击进入:hostkvm官方网站地址hos...

wx.qq.comyao为你推荐
-
程序微信5我的"点绛唇"getIntjava支持ipadcss3圆角如何用CSS实现圆角矩形?win10445端口Win10系统开放端口号怎样查看?用itunes备份如何用iTunes备份iPhone数据googleadsense如何通过Google adsense???迅雷下载速度迅雷下载快慢和什么有关google搜图google搜索的网址是什么?